スモールヒートショックプロテイン
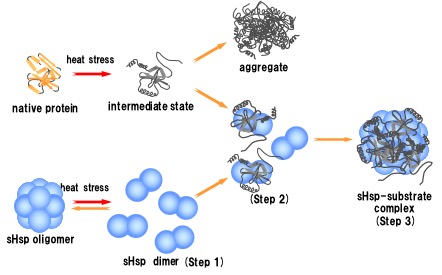
スモールヒートショックプロテイン(sHsp)はショウジョウバエにおいて熱ショックにより誘導される機能不明のタンパク質として同定され、1993年にBucherらによりタンパク質の熱凝集を抑制する分子シャペロンであることが報告された。sHspは分子量12-43 kDaのサブユニットが9-48個会合したホモオリゴマー構造を持ち、生物界に普遍的に存在する。約80アミノ酸残基からなるα-クリスタリンドメインを有することが特徴であるが、配列の相同性は低く、それを挟むN末端及びC末端領域のアミノ酸配列は極めて多様である。これまでに超好熱性古細菌Methanocaldococcus jannaschii由来MjHsp16.5、超好熱性古細菌Sulfolobus tokodaii 由来StHsp14.0、小麦Triticum aestivum 由来TaHsp16.9、分裂酵母由来SpHsp16.0のX線結晶構造が明らかされている。古細菌由来のsHspは24量体球状構造をとるのに対し、分裂酵母由来sHspは16量体、小麦由来sHspは6個のサブユニットから成る円盤が2つ重なった12量体のホモオリゴマーを形成していた。全体構造は異なっているが、いずれの場合も、α-クリスタリンドメインはβ-サンドイッチ構造を形成しており、サブユニット間でβ-ストランド同士が相互作用することで安定なダイマーを形成している。このダイマー構造を基本構造単位に、sHspはホモオリゴマーを形成していると考えられている。ホモオリゴマーの状態では、sHspはシャペロンとしての機能を示さず、熱などのストレスにより、ダイマーに解離することにより疎水性に富む領域を露出し、変性タンパク質の不可逆的凝集を抑制するものと考えられている。しかし、オリゴマーが完全に解離しなくともタンパク質の凝集を抑制するという報告もあり、凝集抑制機構に関する統一した見解は得られていない。sHspは他のタンパク質の不可逆的凝集を防ぐ分子シャペロン活性を有するが、Hsp70やシャペロニンのようにATP依存的なリフォールディング活性はない。従って、sHspに補足された基質はHsp104及びHsp70/40システムなど他の分子シャペロンの作用によって基質-sHsp複合体から放出され、リフォールディングされると考えられている。sHspは細胞における異常なタンパク質の凝集を防いでおり、タンパク質凝集病の発生を防いでいます。我々は、sHspの温度依存的構造変化機構の解明と動物由来sHspの構造とそのタンパク質保護機構の解明を行なっています。
sHspの構造
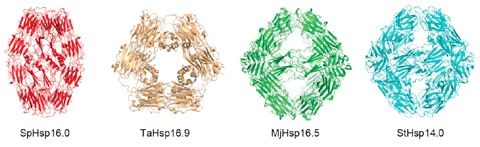
sHspのタンパク質保護機構モデル
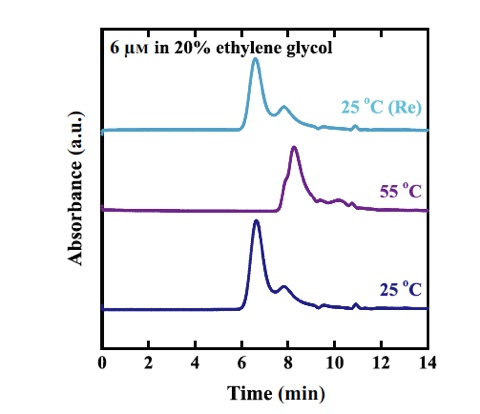
CHO 細胞由来sHspの温度依存的構造変化
代表論文
1: Functional and structural characterization of HspB1/Hsp27 from Chinese hamster ovary cells.
FEBS Open Bio. (2019) 9:1826-1834.
doi: 10.1002/2211-5463.12726. LINK
2: Nonequivalence observed for the 16-meric structure of a small heat shock protein, SpHsp16.0, from Schizosaccharomyces pombe.
Structure. (2013) 21:220-8.
doi: 10.1016/j.str.2012.11.015. LINK
3: Role of the IXI/V motif in oligomer assembly and function of StHsp14.0, a small heat shock protein from the acidothermophilic archaeon, Sulfolobus tokodaii strain 7.
Proteins. (2008) 71:771-82.
doi: 10.1002/prot.21762. PMID: 17979194.
4: Interaction of a small heat shock protein of the fission yeast, Schizosaccharomyces pombe, with a denatured protein at elevated temperature.
J Biol Chem. (2005) 280:32586-93.
doi: 10.1074/jbc.M504121200.
スモールヒートショックプロテイン(sHsp)はショウジョウバエにおいて熱ショックにより誘導される機能不明のタンパク質として同定され、1993年にBucherらによりタンパク質の熱凝集を抑制する分子シャペロンであることが報告された。sHspは分子量12-43 kDaのサブユニットが9-48個会合したホモオリゴマー構造を持ち、生物界に普遍的に存在する。約80アミノ酸残基からなるα-クリスタリンドメインを有することが特徴であるが、配列の相同性は低く、それを挟むN末端及びC末端領域のアミノ酸配列は極めて多様である。これまでに超好熱性古細菌Methanocaldococcus jannaschii由来MjHsp16.5、超好熱性古細菌Sulfolobus tokodaii 由来StHsp14.0、小麦Triticum aestivum 由来TaHsp16.9、分裂酵母由来SpHsp16.0のX線結晶構造が明らかされている。古細菌由来のsHspは24量体球状構造をとるのに対し、分裂酵母由来sHspは16量体、小麦由来sHspは6個のサブユニットから成る円盤が2つ重なった12量体のホモオリゴマーを形成していた。全体構造は異なっているが、いずれの場合も、α-クリスタリンドメインはβ-サンドイッチ構造を形成しており、サブユニット間でβ-ストランド同士が相互作用することで安定なダイマーを形成している。このダイマー構造を基本構造単位に、sHspはホモオリゴマーを形成していると考えられている。ホモオリゴマーの状態では、sHspはシャペロンとしての機能を示さず、熱などのストレスにより、ダイマーに解離することにより疎水性に富む領域を露出し、変性タンパク質の不可逆的凝集を抑制するものと考えられている。しかし、オリゴマーが完全に解離しなくともタンパク質の凝集を抑制するという報告もあり、凝集抑制機構に関する統一した見解は得られていない。sHspは他のタンパク質の不可逆的凝集を防ぐ分子シャペロン活性を有するが、Hsp70やシャペロニンのようにATP依存的なリフォールディング活性はない。従って、sHspに補足された基質はHsp104及びHsp70/40システムなど他の分子シャペロンの作用によって基質-sHsp複合体から放出され、リフォールディングされると考えられている。sHspは細胞における異常なタンパク質の凝集を防いでおり、タンパク質凝集病の発生を防いでいます。我々は、sHspの温度依存的構造変化機構の解明と動物由来sHspの構造とそのタンパク質保護機構の解明を行なっています。
sHspの構造

sHspのタンパク質保護機構モデル

CHO 細胞由来sHspの温度依存的構造変化

代表論文
1: Functional and structural characterization of HspB1/Hsp27 from Chinese hamster ovary cells.
FEBS Open Bio. (2019) 9:1826-1834.
doi: 10.1002/2211-5463.12726. LINK
2: Nonequivalence observed for the 16-meric structure of a small heat shock protein, SpHsp16.0, from Schizosaccharomyces pombe.
Structure. (2013) 21:220-8.
doi: 10.1016/j.str.2012.11.015. LINK
3: Role of the IXI/V motif in oligomer assembly and function of StHsp14.0, a small heat shock protein from the acidothermophilic archaeon, Sulfolobus tokodaii strain 7.
Proteins. (2008) 71:771-82.
doi: 10.1002/prot.21762. PMID: 17979194.
4: Interaction of a small heat shock protein of the fission yeast, Schizosaccharomyces pombe, with a denatured protein at elevated temperature.
J Biol Chem. (2005) 280:32586-93.
doi: 10.1074/jbc.M504121200.