プレフォルディン
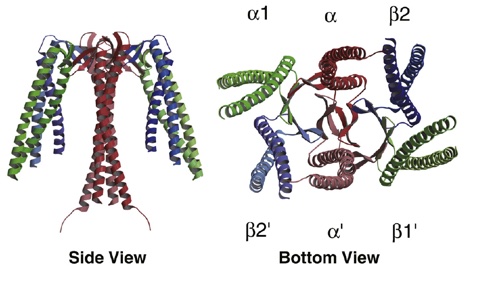
プレフォルディン (Prefoldin)はシャペロニンと同様に真核生物の細胞質、古細菌に存在する分子シャペロンです。古細菌のプレフォルディンは真核生物のプレフォルディンと同様にクラゲ状の構造をしています。プレフォルディンは6つのサブユニットからなり、真核生物の場合全て異なるサブユニットから成るのに対し、古細菌の場合2種(αとβ)のサブユニットから成りα2β4という割合で形成されます。プレフォルディンの機能はタンパク質の凝集抑制であり、RNAから翻訳された直後のタンパク質(機能する形になる前段階)や変性状態のタンパク質を捕捉し、それらの凝集によって細胞に害が及ぶのを防ぎます。プレフォルディンの変性タンパク質を捕捉する分子メカニズムは未解明です。これまでの成果からプレフォルディンの触手のように伸びた部分が変性タンパク質と相互作用することがわかってきました。具体的にどのアミノ酸が変性タンパク質との結合重要であるか明らかにする研究が当研究室では現在精力的に行われています。また近年の研究から、プレフォルディンはグループII型シャペロニンへ変性タンパク質を受け渡す機能を持つことが分かりました。我々はプレフォルディンとグループII型シャペロニンが共役する具体的な反応機構や、プレフォルディン-変性タンパク質-2型シャペロニンという三者間の相互作用を解明などを行なっています。人の細胞内で、タンパク質の恒常性維持に重要な役割を担っており、タンパク質凝集形成を防ぐことで、病気の発症を防いでいます。そのメカニズムの解明を目指した研究も行なっています。
Pyrococcus horikoshii 由来プレフォルディンの構造
主要論文
1: Prefoldin, a jellyfish-like molecular chaperone: functional cooperation with a group II chaperonin and beyond.
Biophys Rev. (2018) 10:339-345.
doi: 10.1007/s12551-018-0400-0. LINK
2: Expression, Functional Characterization, and Preliminary Crystallization of the Cochaperone Prefoldin from the Thermophilic Fungus Chaetomium thermophilum.
Int J Mol Sci. (2018) 19:2452.
doi: 10.3390/ijms19082452. LINK
3: Structure and molecular dynamics simulation of archaeal prefoldin: the molecular mechanism for binding and recognition of nonnative substrate proteins.
J Mol Biol. (2008) 376:1130-41.
doi: 10.1016/j.jmb.2007.12.010.
4: Kinetics and binding sites for interaction of the prefoldin with a group II chaperonin: contiguous non-native substrate and chaperonin binding sites in the archaeal prefoldin. J Biol Chem. (2004) 279:31788-95.
doi: 10.1074/jbc.M402889200. LINK
プレフォルディン (Prefoldin)はシャペロニンと同様に真核生物の細胞質、古細菌に存在する分子シャペロンです。古細菌のプレフォルディンは真核生物のプレフォルディンと同様にクラゲ状の構造をしています。プレフォルディンは6つのサブユニットからなり、真核生物の場合全て異なるサブユニットから成るのに対し、古細菌の場合2種(αとβ)のサブユニットから成りα2β4という割合で形成されます。プレフォルディンの機能はタンパク質の凝集抑制であり、RNAから翻訳された直後のタンパク質(機能する形になる前段階)や変性状態のタンパク質を捕捉し、それらの凝集によって細胞に害が及ぶのを防ぎます。プレフォルディンの変性タンパク質を捕捉する分子メカニズムは未解明です。これまでの成果からプレフォルディンの触手のように伸びた部分が変性タンパク質と相互作用することがわかってきました。具体的にどのアミノ酸が変性タンパク質との結合重要であるか明らかにする研究が当研究室では現在精力的に行われています。また近年の研究から、プレフォルディンはグループII型シャペロニンへ変性タンパク質を受け渡す機能を持つことが分かりました。我々はプレフォルディンとグループII型シャペロニンが共役する具体的な反応機構や、プレフォルディン-変性タンパク質-2型シャペロニンという三者間の相互作用を解明などを行なっています。人の細胞内で、タンパク質の恒常性維持に重要な役割を担っており、タンパク質凝集形成を防ぐことで、病気の発症を防いでいます。そのメカニズムの解明を目指した研究も行なっています。
Pyrococcus horikoshii 由来プレフォルディンの構造

主要論文
1: Prefoldin, a jellyfish-like molecular chaperone: functional cooperation with a group II chaperonin and beyond.
Biophys Rev. (2018) 10:339-345.
doi: 10.1007/s12551-018-0400-0. LINK
2: Expression, Functional Characterization, and Preliminary Crystallization of the Cochaperone Prefoldin from the Thermophilic Fungus Chaetomium thermophilum.
Int J Mol Sci. (2018) 19:2452.
doi: 10.3390/ijms19082452. LINK
3: Structure and molecular dynamics simulation of archaeal prefoldin: the molecular mechanism for binding and recognition of nonnative substrate proteins.
J Mol Biol. (2008) 376:1130-41.
doi: 10.1016/j.jmb.2007.12.010.
4: Kinetics and binding sites for interaction of the prefoldin with a group II chaperonin: contiguous non-native substrate and chaperonin binding sites in the archaeal prefoldin. J Biol Chem. (2004) 279:31788-95.
doi: 10.1074/jbc.M402889200. LINK