シャペロニン
1988年Ellisらによって,Hsp60ファミリーは,典型的な分子シャペロンということで,シャペロニンと名づけられた。シャペロニンは分子シャペロンの中でもタンパク質のフォールディングを助ける主役を担っており,現在最も解析が進んでいる分子シャペロングループである。シャペロニンは従来,真正細菌や真核生物のオルガネラ(葉緑体,ミトコンドリア)にのみに存在し,真核生物の細胞質やその起源と考えられている古細菌には存在しないと考えられてきた。しかし,1991年に好酸好熱性古細菌 Sulfolobus shibataeの熱ショックタンパク質TF55がシャペロニン特有の2重リング構造を形成して,変性タンパク質と結合し,真核生物の細胞質に存在するTCP-1(T-complex polypeptide 1)というタンパク質と高い相同性を示すということが明らかになり,これらが古細菌と真核生物の細胞質のシャペロニンであることが判明した。その後の研究から,新たに見つかったシャペロニンは,従来から知られているシャペロニン(グループ I型)とは四次構造など様々な点で異なる特徴を有することが明らかとなり,真核細胞の細胞質や古細菌に存在するシャペロニンはグループII型として分類されるようになった。真核生物の細胞質や古細菌に存在するグループII型シャペロニンは,大腸菌のGroEに代表されるグループI型とは、補因子のGroESを必要としないことなど構造や反応機構が異なっている。
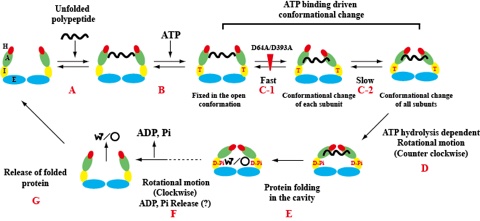
我々は,超好熱性古細菌Thermococcus由来グループII型シャペロニンの構造解析と分子シャペロン機能の解明を行い。Open構造で変性タンパク質を内部の穴に取り込み、ATP依存的構造変化によりタンパク質のフォールディングを促進するメカニズムを解明した。特に、構造変化においてリングが回転することを1分子解析により明らかにした。また、真正細菌由来グループII型シャペロニン CCTを大腸菌で生産することに成功し、その反応機構の解明をおこなった。現在、CCTがオートファジーにより分解されるメカニズムとその生理的意味の解明を目的に研究を進めている。
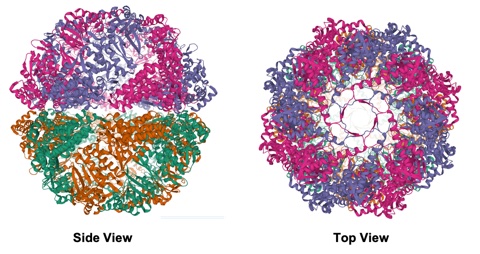
超好熱性古細菌Thermococcus由来グループII型シャペロニンの構造
グループII型シャペロニンのタンパク質フォールディング機構
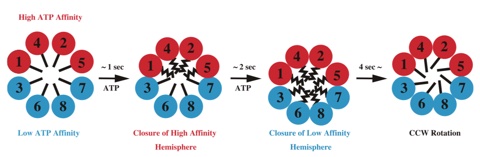
CCTの構造変化機構
代表論文
1: Bridging human chaperonopathies and microbial chaperonins.
Commun Biol. (2019) 2:103.
doi:10.1038/s42003-019-0318-5. LINK
2: Asymmetry in the function and dynamics of the cytosolic group II chaperonin CCT/TRiC.
PLoS One. (2017) 12:e0176054.
doi: 10.1371/journal.pone.0176054. LINK
3: Dissection of the ATP-dependent conformational change cycle of a group II chaperonin.
J Mol Biol. (2014) 426:447-59.
doi: 10.1016/j.jmb.2013.09.034.
4: ATP dependent rotational motion of group II chaperonin observed by X-ray single molecule tracking.
PLoS One. (2013) 8:e64176.
doi: 10.1371/journal.pone.0064176. LINK
5: Sequential action of ATP-dependent subunit conformational change and interaction between helical protrusions in the closure of the built-in lid of group II chaperonins.
J Biol Chem. (2008) 283(50):34773-84.
doi: 10.1074/jbc.M805303200. LINK
6: Characterization of archaeal group II chaperonin-ADP-metal fluoride complexes: implications that group II chaperonins operate as a "two-stroke engine".
J Biol Chem. (2005) 280:40375-83.
doi: 10.1074/jbc.M506785200.
7: Crystal structures of the group II chaperonin from Thermococcus strain KS-1: steric hindrance by the substituted amino acid, and inter-subunit rearrangement between two crystal forms.
J Mol Biol. (2004) 335:1265-78.
doi: 10.1016/j.jmb.2003.11.028.
1988年Ellisらによって,Hsp60ファミリーは,典型的な分子シャペロンということで,シャペロニンと名づけられた。シャペロニンは分子シャペロンの中でもタンパク質のフォールディングを助ける主役を担っており,現在最も解析が進んでいる分子シャペロングループである。シャペロニンは従来,真正細菌や真核生物のオルガネラ(葉緑体,ミトコンドリア)にのみに存在し,真核生物の細胞質やその起源と考えられている古細菌には存在しないと考えられてきた。しかし,1991年に好酸好熱性古細菌 Sulfolobus shibataeの熱ショックタンパク質TF55がシャペロニン特有の2重リング構造を形成して,変性タンパク質と結合し,真核生物の細胞質に存在するTCP-1(T-complex polypeptide 1)というタンパク質と高い相同性を示すということが明らかになり,これらが古細菌と真核生物の細胞質のシャペロニンであることが判明した。その後の研究から,新たに見つかったシャペロニンは,従来から知られているシャペロニン(グループ I型)とは四次構造など様々な点で異なる特徴を有することが明らかとなり,真核細胞の細胞質や古細菌に存在するシャペロニンはグループII型として分類されるようになった。真核生物の細胞質や古細菌に存在するグループII型シャペロニンは,大腸菌のGroEに代表されるグループI型とは、補因子のGroESを必要としないことなど構造や反応機構が異なっている。
我々は,超好熱性古細菌Thermococcus由来グループII型シャペロニンの構造解析と分子シャペロン機能の解明を行い。Open構造で変性タンパク質を内部の穴に取り込み、ATP依存的構造変化によりタンパク質のフォールディングを促進するメカニズムを解明した。特に、構造変化においてリングが回転することを1分子解析により明らかにした。また、真正細菌由来グループII型シャペロニン CCTを大腸菌で生産することに成功し、その反応機構の解明をおこなった。現在、CCTがオートファジーにより分解されるメカニズムとその生理的意味の解明を目的に研究を進めている。
超好熱性古細菌Thermococcus由来グループII型シャペロニンの構造

グループII型シャペロニンのタンパク質フォールディング機構

CCTの構造変化機構

代表論文
1: Bridging human chaperonopathies and microbial chaperonins.
Commun Biol. (2019) 2:103.
doi:10.1038/s42003-019-0318-5. LINK
2: Asymmetry in the function and dynamics of the cytosolic group II chaperonin CCT/TRiC.
PLoS One. (2017) 12:e0176054.
doi: 10.1371/journal.pone.0176054. LINK
3: Dissection of the ATP-dependent conformational change cycle of a group II chaperonin.
J Mol Biol. (2014) 426:447-59.
doi: 10.1016/j.jmb.2013.09.034.
4: ATP dependent rotational motion of group II chaperonin observed by X-ray single molecule tracking.
PLoS One. (2013) 8:e64176.
doi: 10.1371/journal.pone.0064176. LINK
5: Sequential action of ATP-dependent subunit conformational change and interaction between helical protrusions in the closure of the built-in lid of group II chaperonins.
J Biol Chem. (2008) 283(50):34773-84.
doi: 10.1074/jbc.M805303200. LINK
6: Characterization of archaeal group II chaperonin-ADP-metal fluoride complexes: implications that group II chaperonins operate as a "two-stroke engine".
J Biol Chem. (2005) 280:40375-83.
doi: 10.1074/jbc.M506785200.
7: Crystal structures of the group II chaperonin from Thermococcus strain KS-1: steric hindrance by the substituted amino acid, and inter-subunit rearrangement between two crystal forms.
J Mol Biol. (2004) 335:1265-78.
doi: 10.1016/j.jmb.2003.11.028.