がんオルガノイドテクノロジーの開発
がんオルガノイドとは
がん組織は、自己複製能と分化能を持つわずかながん幹細胞と、それに由来する分化細胞で構成されています。がん幹細胞は、がんの転移や再発、抗がん剤など治療薬に対する高い抵抗性の要因の1つとされています。そのため、がん治療の標的として重要視されていますが、従来の細胞株モデルではがん幹細胞を維持することが難しく、体内のがん組織を十分に再現できないという課題があります。この課題を解決する新たなモデルとしてがんオルガノイドが注目されています。がんオルガノイドは、がん細胞から作製された3次元構造体で、患者由来組織の特性(表現型や遺伝子型)を保持しながら、生体外で増殖します。この特性により、患者に最適な治療薬を生体外で正確かつ迅速に評価できるため、個別化医療への応用が期待されています。
がんオルガノイドの解析技術
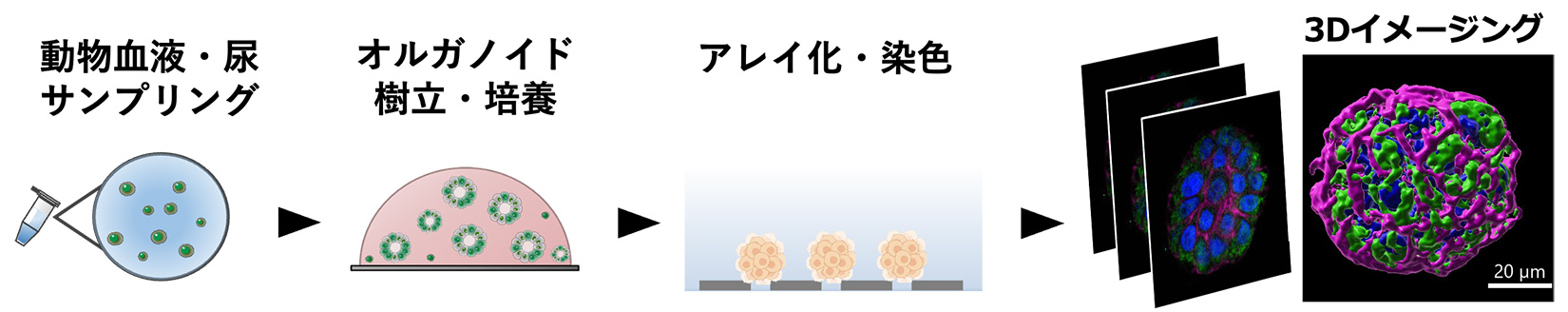
当研究室では、これまでに3Dイメージングを可能にする顕微鏡を用いて、MCAでアレイ化した細胞を単一細胞レベルで評価することに成功しました。現在、この技術をがんオルガノイドに応用し、単一オルガノイドレベルでの抗がん剤評価技術の確立を進めています。さらに、ヒトやイヌの血液や尿中に含まれる微量ながん細胞を対象に、MCA法を用いて細胞を濃縮し、その後、細胞外マトリックスで培養する一連のプラットフォームを構築しています。この技術を用いて、液体サンプルからがんオルガノイドを樹立し、そのオルガノイドを使った抗がん剤評価を行うことを目指しています。これが実現すれば、生体外で正確かつ迅速に患者に最適な治療薬の選択が可能となり、個別化医療に貢献できると考えています。