LVTのこぼれ話などを不定期で紹介。
中には有用な情報もあるかも?
インスタ始めました
学術的というより、見た目が美しい標本を掲載しています。 ご覧になった方々が獣医学に興味を持つきっかけになれば幸いです。 下の写真は掲載例です。 フォローしていただけると中の人が小躍りして喜びます。
- >>> Link to Instagram <<<
顕微鏡での撮影について その2
今回は顕微鏡に取り付けた市販のミラーレス一眼をパソコンから操作する方法について紹介します。
私がプライベートでも愛用するNikon製で揃えてみました。
【撮影システム概要】
顕微鏡:Nikon, Ci-L
変換アダプタ1:Nikon, TV直筒0.55x Y-TV55
変換アダプタ2:Nikon, Fマウントアダプター DS-F
変換アダプタ3:K&F Concept, KF-NFZ マウントアダプター
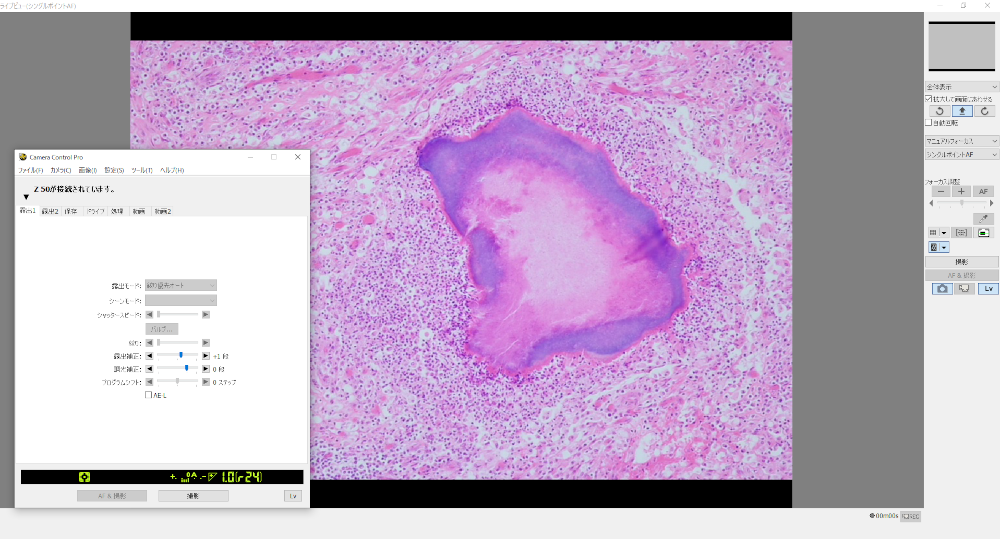
カメラ:Nikon, Z50
ソフトウェア:Nikon, Camera Control Pro2

Nikonさんは純正でFマウントの顕微鏡用カメラを販売しているため、 FマウントアダプタもNikon純正のものがあります。 これを利用することで、FマウントのAPS-C機を取り付けることが可能です。なお、フルサイズ機を使用する場合には変換アダプタ2は「DS-F2.5」が適切となります。
当初は私物の一眼レフ D7000を取り付けていたのですが、シャッターを切る振動でブレが生じるため(Qモードである程度軽減できました)、 ミラーレス機であるZ50を使用しました。 このため、FマウントからさらにZマウントに切り替えるアダプタが必要となっています。
Z50用に純正のF→Zマウントアダプタも販売されていますが、今回の目的にはオーバースペックですので、廉価版であるサードパーティーのアダプタを使用しています。 画角は接眼レンズを通して見るよりもやや広い範囲が結像されるため、対物4xで撮影する際にはハネノケを下げる必要があります。
Camera Control Pro2を使用することで、パソコン上でZ50を操作することが可能になります。
以前に紹介した方法では、撮影した画像はカメラのSDカードに保存されるため、データをパソコンに移し替える必要がありました。
今回の方法では画像データはパソコンに保存されるため、報告書等の作成がとてもスムーズにはかどります。
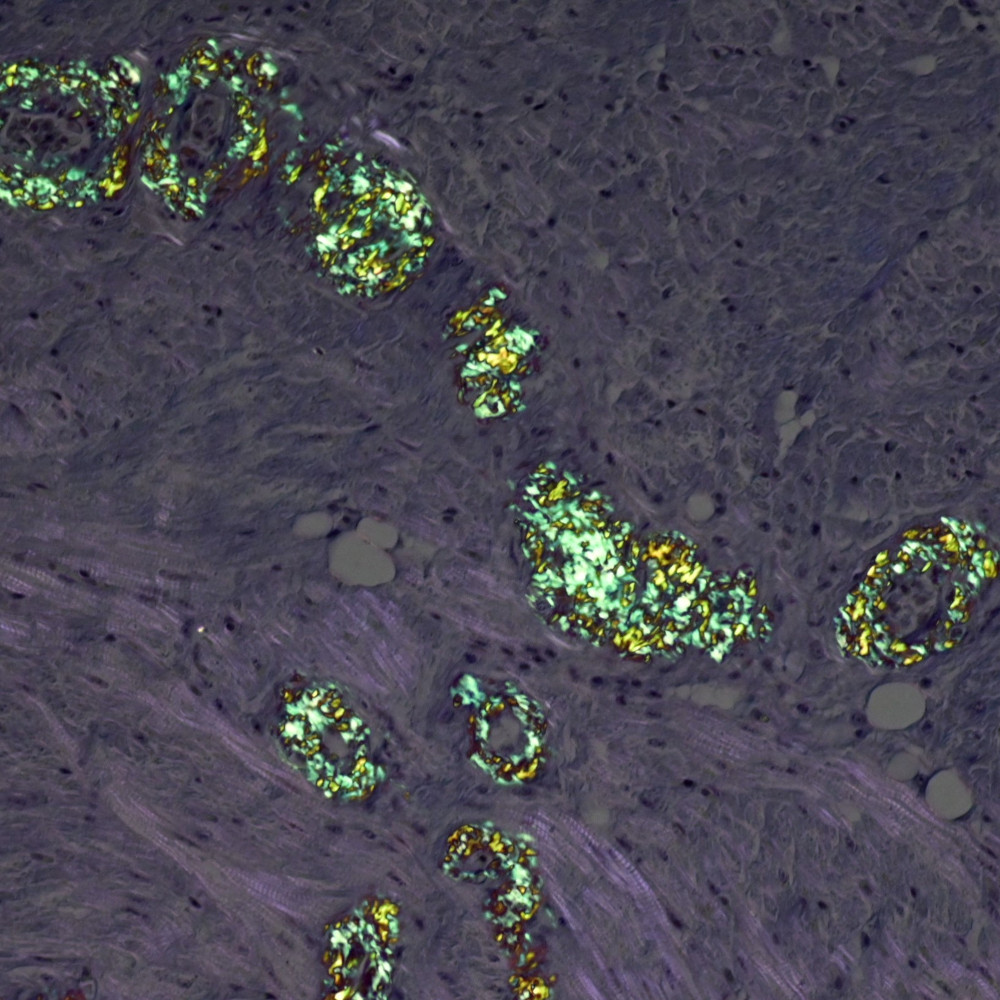
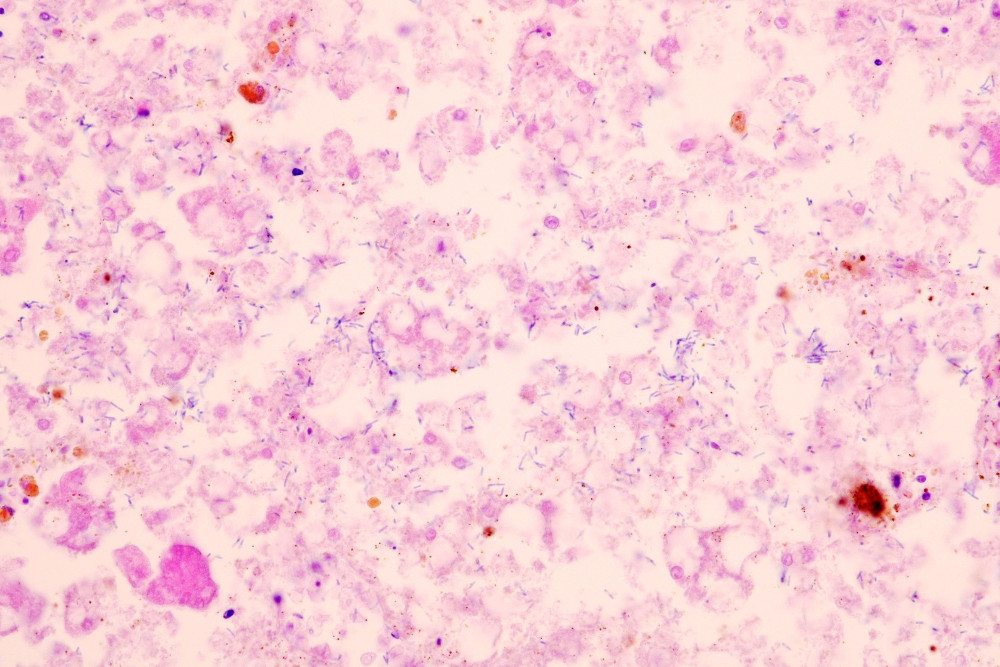
本システムで撮影したアミロイド(コンゴレッド偏光)
言わずもがな、Z50は非常に性能の高いカメラであり、撮影した組織画像のクオリティは圧巻です。
同じメーカーで一式揃えると、相性が良いですね。
アミロイドーシスについて
私たちの研究テーマであるアミロイドーシスはとても謎の多い病気です。 学生さんもご家族に研究テーマを話す際に「そもそもアミロイドって何」から苦労するそうです。 しかしながら、アルツハイマー病やパーキンソン病をはじめ、アミロイドーシス患者は年々増え続けており、かつてと比べると身近な病気となってきました。
獣医学領域においても、アミロイドーシスは決して珍しくない病気です。 一方で、どこか素人には手を出しづらい取っつきにくさ(何だか難しそう・・・?)があるのではないでしょうか。 この度、獣医師向けに動物のアミロイドーシスについてのまとめページを作りました。 興味がございましたら、是非ご一読ください。 獣医学領域におけるアミロイドーシス研究の更なる発展を願っています。
- >>> アミロイドーシスについて学ぶ <<<
病理の小話 ①固定について
以前、LVTの自由ゼミにて病理手技の基本原理についてお話ししたことがあったのですが、最近学生さんに話を振ったところほとんど忘れられていたので(悲しいなぁ…)、時間があるときに少しずつ書き留めていこうかと思います。
固定~HE染色標本の出来るまでの工程を少しずつお話出来ればと考えています。
今回はこれらのうち、固定についてお話していきます。
(※ なお、本コラムは病理初心者さん向けに書いています。
病理ベテランの諸先輩方はどうか生温かい目で見守っていただけると幸いです。)
まず、そもそも、固定とは何のために実施するのでしょうか?
生きている動物の細胞では、栄養素や酸素などの物質交換が絶えず行われており、結合織や細胞骨格により構造が保たれています。
しかしながら、循環障害や切除によって物質供給が遮断されると、細胞死や自己融解、細菌繁殖といった死後変化が進行します。
自己融解と死後桿菌の増殖
法医病理学などの例外を除いて、病理組織学ではなるべく生きている状態に近い組織形態を観察するのが理想です。 死後変化をいかに防ぎ、顕微鏡観察に適した組織形態を維持するかが、病理組織学における固定の本質といえるでしょう。
「顕微鏡観察に適した組織形態」とざっくりと表現してしまいましたが、観察目的に応じて、何が「好都合」かは変化します。 例えば脂肪の溶出を防ぎたいのであれば凍結による固定が良いでしょうし、抗体の反応性低下を防ぐためにアルコール系固定液を選択することもあります。 適切な病理組織学的解析を実施するためには、固定の原理や各固定液の特性を理解しなければなりません。
固定の種類と原理について
組織の固定とは簡単に言うと、蛋白質の腐敗や分解を防ぐ行為です。 その方法には大きく分けて凍結固定・凝固固定・架橋固定の3種類があります。
凍結固定とは、採材した生の組織を液体窒素を用いて瞬間的に凍結することで、構造を維持したまま薄切する手法です。 切片作製には特別な設備が必要で、一度に大量のサンプルを処理するのには向きませんが、通常包埋過程で溶出してしまう脂肪や、変性を受けやすい抗原の証明には有利な手法です。
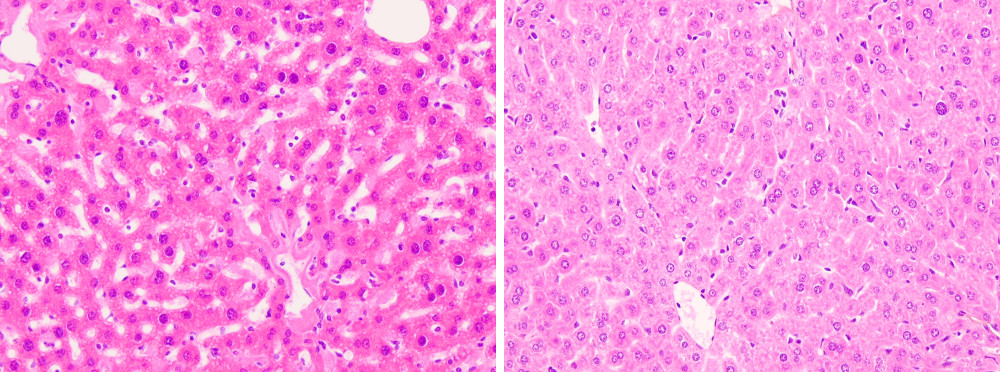
凝固固定とは、脱水によりタンパク質の親水性を減少させ、また疎水結合を破壊することによる固定法です。 アルコールやアセトンなどがこれに含まれます。 脱水による細胞収縮のため、ややギュッと詰まった組織像になります。 また、水を用いないため、水溶性分子の保存性に優れています。
架橋固定とは、生体分子間に共有結合をつくることによる固定法です。 ホルマリンやグルタルアルデヒドなどがこれに含まれます。 一般に最もよく用いられており、HE染色像が(好みは人それぞれでしょうが)最も美しい固定法です。 一方で、架橋によってポリペプチド鎖の構造が変化しエピトープが隠れてしまうことが多いため、免疫染色の際には特別な前処理を必要とする場合があります。
マウス肝臓 左:アルコール固定、 右:ホルマリン固定
ホルムアルデヒド系固定液について
ブアンやダビッドソン、メタカーンなど各種固定液の特性などは「獣医病理学実習マニュアル」や「獣医病理学総論」を読んでいただくとして、今回は意外とご存じない方が多い「ホルマリン」「中性緩衝ホルマリン」「パラホルムアルデヒド固定液」の違いについてお話しします。
ホルマリンとはホルムアルデヒド水溶液のことを指します。ホルマリン原液として販売されているものは37%のホルムアルデヒド水溶液なので、10%ホルマリンとは約4%ホルムアルデヒド水溶液を意味します。 ホルムアルデヒドはそれ自身でつながり合う性質があり、長鎖状につながってパラホルムアルデヒドを形成します。 遊離した単体ホルムアルデヒドが多いほど、固定力は強くなります。 市販のホルマリン液はパラホルムアルデヒドの生成を抑える目的で、メタノールを混ぜている場合が多く、架橋固定と凝固固定を兼ね備えており、強い固定力を有しています。
中性緩衝ホルマリンとは名前の通り、中性に保たれたホルマリンのことです。 非緩衝のホルマリンは組織固定時に酸化してギ酸を生じ、これが赤血球由来のヘマチンとホルマリン色素(酸化ヘマチン)を形成します。 ホルマリンを中性に保つことでホルマリン色素の形成を予防することが可能ですが、非緩衝ホルマリンと比べると固定力は弱くなります。 なお、生成したホルマリン色素は、切片をアルカリ水溶液で処理することで除去が可能です。
上述の通り、“パラ”ホルムアルデヒドとはホルムアルデヒドが連なったものです。 ホルムアルデヒドは常温で気体なので、パラホルムアルデヒドの状態で保存します。 パラホルムアルデヒド水溶液の中には、単体ホルムアルデヒドもあれば、それが連なったパラホルムアルデヒドも存在するため、パラホルムアルデヒド水溶液もホルマリンも実質的には同じものといえるでしょう。 ただし、我々がパラホルムアルデヒド水溶液を選択する場合は、たいてい抗原性保持の目的ために中性緩衝下で冷固定を実施するのがほとんどです。 ホルマリン液と違ってメタノールも含まないため、単体ホルムアルデヒドの比率も低くなり、固定力はさらにマイルドになっています。
終わりに
固定の種類や原理について、簡単にお話させていただきました。
美しいHE切片を作製するためには「採材、固定、切出し、包埋、薄切、伸展、染色、封入」のそれぞれの工程を理解し、適切に処理しなければなりません。
これらの中で、固定はやり直しの利かない、とても重要な工程です。
普段何気なく実施している各工程の基本原理について、少しでも皆さまの興味のきっかけになれれば幸いです。
次回は包埋についてお話しします。 読者が増えることを願いつつ、請うご期待。
顕微鏡での撮影について その1
LVTの学生部屋には撮影機能付きの顕微鏡(Olympus BX43)が置かれています。 今回はその撮影システムについてお話しします。
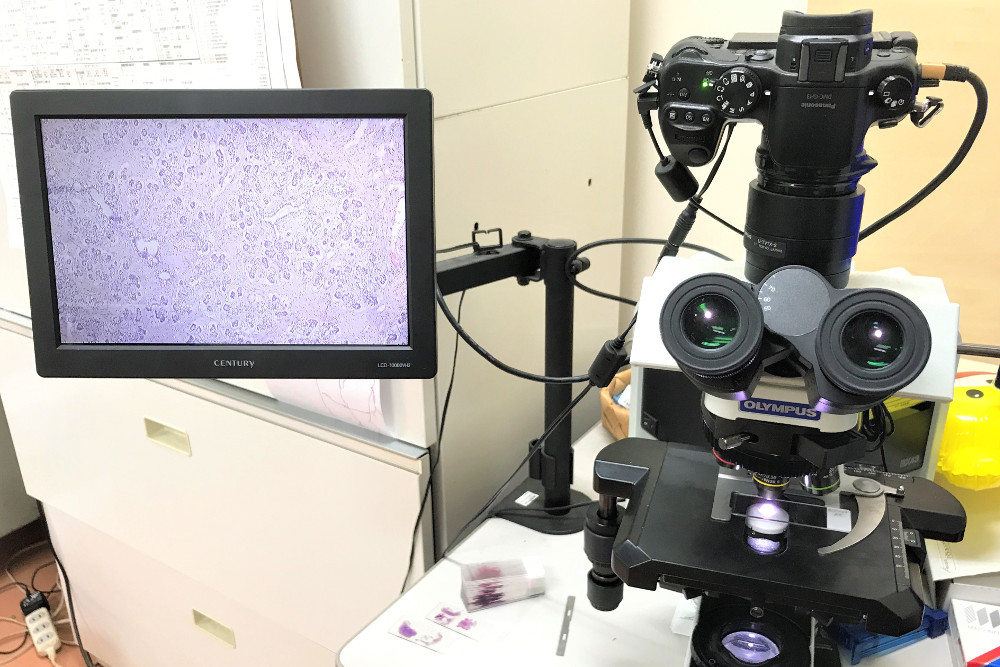
Olympusの生物顕微鏡には純正の撮影システムが売られています(DPシリーズ)。 ただ、当然ながら純正品は品質が高い分、それなりに値が張ります。 スタートアップ時のLVTは(現在もですが・・・)金持ちラボではなかったので、なんとか安く済ませようと模索して完成したのが現在の撮影システムでした。
【撮影システム概要】
カメラ:LUMIX DMC-GH3 [Panasonic]
変換アダプタ1:U-TV1X-2, U-TMAD, U-FMT [Olympus]
変換アダプタ2:F Micro Four Thirds Adapter [COSINA]
その他:カメラ用のACアダプタ、DCカプラー、シャッターリモコン [Panasonic]
この撮影システムをHDMIでモニタに出力し、ディスカッションに使っています。 また、同様にプロジェクタにも出力可能です。
GH3のマイクロフォーサーズマウントをBX43のCマウントへ切り替えるために、多くの変換アダプタが必要になっています。 具体的には変換アダプタ1でCマウントからFマウントへ変換し、変換アダプタ2でFマウントからマイクロフォーサーズマウントへ切り替えています。 システム購入時(2013年)にはマイクロフォーサーズからCマウントへ直接切り替えるアダプタが無かったのでこうなりましたが、今はどうでしょう。 ちなみに変換アダプタ2は若干ガタつくので、ビニールテープでぐるぐる巻きにして固定しています。

カメラはマイクロフォーサーズのミラーレス一眼のうち、外部モニタを介してライブビューが出来るものとして、PanasonicのGH3を選択しました(現在GH3は生産中止で、GH4とGH5が販売されています)。
一眼カメラはレンズを付けていなければオートフォーカスが使用できないため、ピントは顕微鏡で合わせる必要があります。 GH3にはライブビューで画面をタッチした所を部分的に拡大してくれる機能があるため、ピント合わせに役立っています。
カメラ本体のシャッターボタンを押して撮影すると振動でブレてしまうので、シャッターリモコンは必須です。 なお、一眼カメラはデフォルトではレンズを付けていないとシャッターが切れないように設定されているので、レンズなしレリーズをONにしておく必要があります。
現在まで4年間使用しましたが、今のところ致命的なトラブルも無く、十分論文に使える画像が撮影できています。 欲を言えば偏光顕微鏡での撮影のために長秒撮影機能が欲しいところですが…。
今の顕微鏡にカメラを取り付けたいけど純正はちょっと…という方は、ぜひ検討してみてはいかがでしょうか?
Macroを用いたImage Jの自動化
LVTでは免疫染色による陽性部位の数値化をImage Jを用いて実施しています。 まずはDAB陽性領域算出の手順をご覧下さい。
- Image Jで画像ファイルを開く。
- Image > Color > Split channelでblueを選択。
- Process > Filter > Medianでノイズを除去。
- Image > Adjust > Thresholdで二値化。
- Analyze > Analyze Particleで測定。
- 二値化した画像ファイルを保存する
- Excelに出力してデータを保存する。
これらの作業を1枚1枚に繰り返していくのは非常に煩雑です。 統計解析の際には数百枚の画像を処理することはザラですので、Image J解析は非常にストレスフルでした。 そこでMacroを用いた自動化を試みました。
MacroはImageJで一連のコマンドを自動化するプログラムです。 試しに上記のコマンドをMacro化したものが以下になります。 参照元と出力先のファイルを指定すれば、参照元に入れた画像ファイルが自動的にImage J解析され、二値化されたTiff画像が出力先に保存されていく仕組みです。
//参照元(ファイルのアドレスをコピペすればOK。その際、「¥」は必ず「¥¥」に書換える。)
inputdirectory = "C:¥¥Users¥¥mrkmt¥¥Desktop¥¥Image J¥¥解析用";
//出力先
outputdirectory = "C:¥¥Users¥¥mrkmt¥¥Desktop¥¥Image J¥¥記録用";
//出力するファイル名の頭につける文字列
prefix = "result ";
//ファイル名を参照元から配列で取得
filelist = getFileList(inputdirectory);
//繰り返し処理
for (i=0; i<filelist.length; i++) {
//ファイルを開く
open(inputdirectory + "¥¥" + filelist[i]);
//二値化前の下処理として、Split Channels, Median(ノイズ処理)を実行
run("Split Channels");
run("Median...", "radius=2");
//二値化
setAutoThreshold("Default");
run("Threshold...");
//二値化の下限上限の輝度について任意の値を設定
setThreshold(0, 120);
setOption("BlackBackground", false);
run("Convert to Mask");
run("Close");
//解析の実行。“size=”の数値は解析で拾うピクセル集合の下限-上限の値である。
run("Analyze Particles...", "size=50-Infinity clear summarize");
//Tiffファイル形式でファイルを出力先に保存
saveAs("Tiff", outputdirectory + "¥¥" + prefix + filelist[i]);
//blue, red, greenファイルを閉じる
close();
close();
close();
}
上記のMacroをtextファイルで保存し、Image J内で実行すれば解析が自動的に進行します。 数値データはSummary内に記録されていきますので、解析終了後にExcelに出力してください。 皆さんもImage Jの自動化で快適研究ライフを送ってくださいね。