Welcome to Ohashi Lab
大橋研究室へようこそ
研究上のポリシー:移動物性の重要性
なぜ、「研究内容」とは別にこのようなページがあるかというと、それはこの研究室が追求したい学理があり、それが常に研究内容の背後にあるからです。少し専門的な用語も含まれるので、化学工学の3年生くらいにならないと難しいかもしれないのですが、少しかみくだいてみました。
学生さんに、化学工学の何が魅力か、と聞くと、よく「実際の社会で使われている学問だから」という意見が聞かれます。それも一つの重要な視点です。一方で私は、化学工学を化学工学足らしめているのは「平衡論」と、それに至る過渡過程を記述する「速度論」であり、特に後者を化学工学の大きな魅力だと感じています。(現実の過渡過程を扱うのは学問体系の中でも機械工学(流体力学)と化学工学くらいであり、化学工学はその中でも化学反応を扱うという点が特徴です)
もう少し書くと・・一年生で熱力学を学ぶと、「平衡」という概念がわかり、熱力学により平衡状態の予測ができるようになります。一方で、我々の生きるこの世界はほとんどが平衡に向かう過程であり、非平衡な世界です。この非平衡な過程が、どのように、どのくらいの速度で進むのか、が大事なわけで、これを決めるのが非平衡物性=移動物性です。例えば「拡散係数」がこの移動物性の代表例です。この移動物性をうまく使うと、工学的にも今までできなかったことがたくさんできるようになります。そんな訳で本研究室では、移動物性に注目して、
①. 移動物性を用いたデバイス設計
②. 移動物性を予測するモデルの構築
③. 移動物性を測定するための系の構築
の3つを研究を支える柱として研究を進めていきたいと考えています。
今まで世の中で用いられてきたプロセスは、蒸留や吸収など、平衡物性を利用するプロセスが主流でした。これに対して近年では移動物性を利用した、より効率的なプロセスが提案されています。例えば膜分離プロセスは、AとBを分けるのに、膜中のA分子の移動速度とB分子の移動速度の差を利用して分離します。これにより、平衡系では成し得なかった高い分離性能を実現できます。例えば水/エタノール系は平衡プロセスではエタノール96%(共沸限界)以上に濃縮することはできませんが、膜プロセスではこれを超える分離が可能になります。このときの分子の移動速度が移動物性(のひとつ)というわけです。
① 移動物性を用いたデバイス設計
この移動物性がわかると役に立つ例として、我々が取り組んできた系を一つ挙げます(現在はタンパク質に関わる研究はやっていませんが)。現代技術では、タンパク質を大腸菌で大量に発現させることができますが、発現させた時点ではタンパク質は凝集して、機能を持っていない状態になっています。タンパク質の機能を取り戻させるためには、タンパク質の正しい三次元構造を取り戻すリフォールディング(フォールド:折りたたむ)というプロセスが必要です(図1a)(研究内容の項も参照) 。
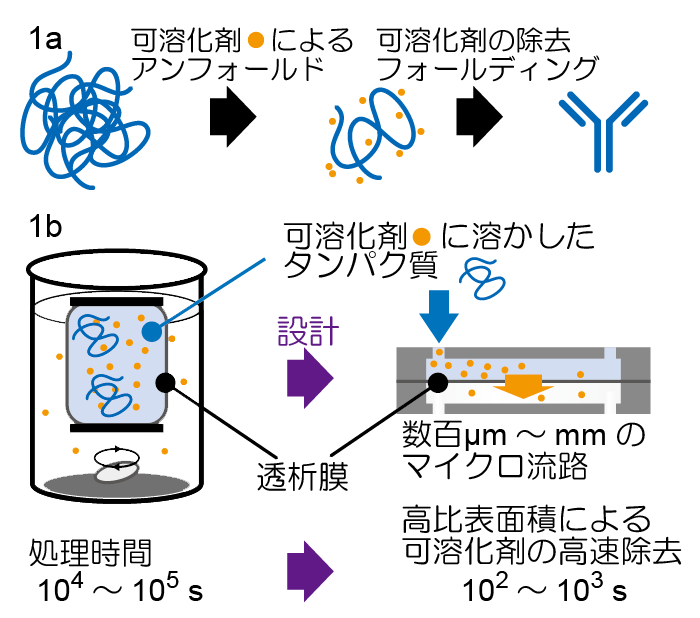
タンパク質を可溶化剤という薬品に溶解してポリペプチドまでほどいた後、可溶化剤を取り除くことによってリフォールディングができます。高濃度でタンパク質をリフォールディングするためには、透析法が有効ですが、これは一般に数時間~数日と時間がかかるプロセスとしても知られています。ただ、時間がかかるとタンパク質が再凝集してしまったりするため、短時間で透析を行いたい、という要望があります。
移動物性を設計に取り入れるとこれが容易に可能になります。透析に時間がかかるということは、透析膜を介した可溶化剤の透過速度が遅いことが原因で、透析膜を高比表面積化することにより高速化が可能です。従来の透析法に比べて10倍の比表面積を稼げるマイクロ流路を実際に作製し、20分の透析時間で設計通りに透析を行うことに成功しています(図1b)。
(※ これを上手く使うと、従来の透析においても、どのくらいの透析時間を設定すると透析膜中の可溶化剤濃度がどのくらい下がるのかを簡単に予想することもできます)
② 移動物性を予測するモデルの構築
さて、この例では実際に透析膜中での分子の移動速度(拡散性)を測定して、それを使うことで設計を行いました。ですが、世の中にはいろいろな膜があるので、測定をせずに移動物性を知ることができれば、設計に非常に役に立つことが予想されます。
そこで、②のお話が出てきます。
例えば、高分子中の分子の拡散性は、高分子や拡散する分子の種類、高分子濃度や温度などによって数桁も変わりうる物性です。つまり、高分子の中では条件によって分子の動きやすさが何千倍も何万倍も変わってしまうということです。高分子を材料として用いるデバイスでは、この違いはとても大きな影響を性能に及ぼし得ます。
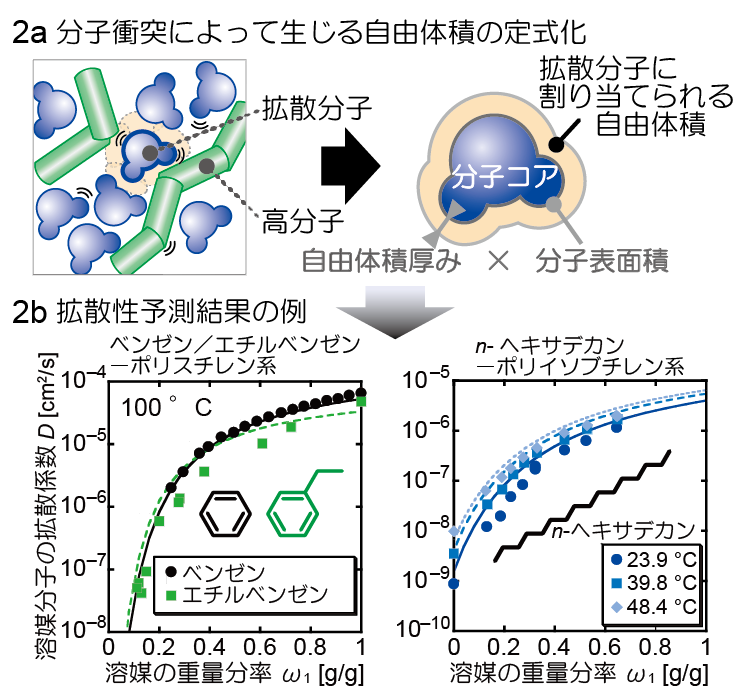
一方で、高分子の種類・溶媒の種類・拡散分子の種類・温度・濃度の組み合わせは無数にあるため、それぞれの系で拡散性をいちいち測定することは、とてもではないですが現実的ではありません。そこで、分子拡散性を予測するためのモデルが必要になってきます。我々は、分子運動のミクロな描像に基づき分子拡散性を予測するための理論モデルの開発に着手しています(図2a)。
図2bは我々のモデルによる予測結果の例で、高分子が溶媒に溶けた系の中において、溶媒分子の拡散性を予測した結果です。プロットが実験値、線が予測値になっていますが、扁平状のベンゼンやエチルベンゼンから、鎖状のn-ヘキサデカンまで、その拡散性を適切に予測できていることがわかります。高分子と拡散する分子の間に水素結合が形成されるような系へのモデル拡張にも成功していて、多様な系での予測を可能にするモデル構築を目指しています。
③ 移動物性を測定するための系の構築
ただここで一つ問題になるのは、論文で公表されている拡散性のデータが充分な量ではないということです。これは拡散性を測るのに最も用いられている装置がpulsed field gradient nuclear magnetic resonance (PFG-NMR)という磁場勾配を掛けられるような特殊なNMRなのですが、拡散性の測定を行うこと自体が容易ではないためです。そこで我々は、PFG-NMRに替わる拡散性の測定手法を開発する必要があります。これが③のお話です。
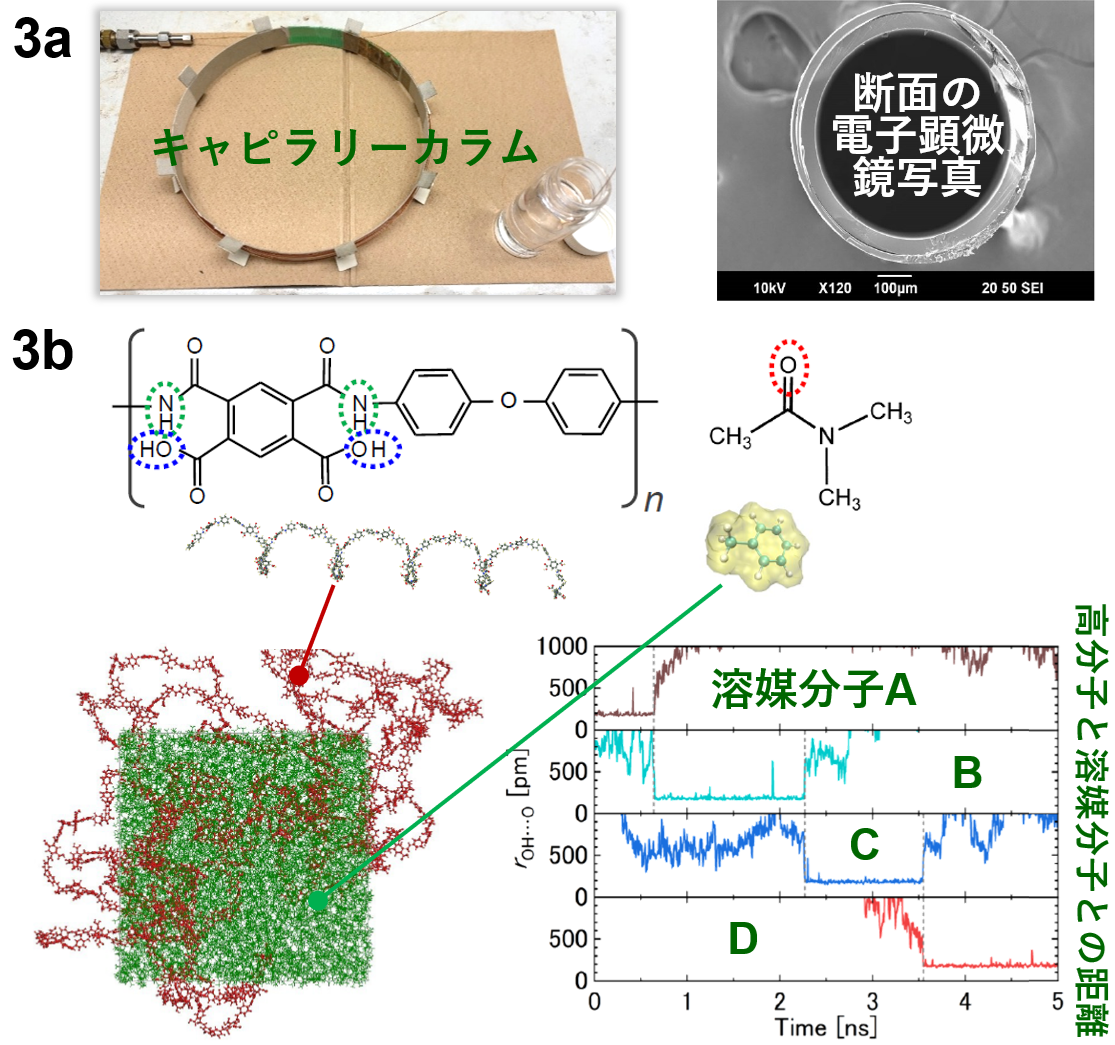
その有力候補がキャピラリーカラムガスクロマトグラフィー法という手法です。ガスクロマトグラフィー(GC)は非常に再現性の良い装置として知られていて、これに中空の細管であるキャピラリーカラム(図3a)を組み合わせることで、様々な溶媒に対して様々な温度のデータを高速かつ自動で測定できる手法の開発を行っています。 キャピラリーカラムの内壁に拡散係数を測りたい対象の高分子を非常に薄く塗布する(数マイクロメートル以下)ことで、測定にかかる時間を大きく短縮し、再現性が高く質の良いデータを取得することに成功しています。
また、分子シミュレーションによる拡散現象の解析も行っています。分子シミュレーションではコンピュータ上で高分子と拡散分子を配置して、その中の分子の運動を解析する(図3b)ことで、新しい知見を得ることができます。例えば、②の項で少し述べた水素結合を形成する系のモデルは、分子シミュレーションの結果から導き出されたものです。
たくさんの拡散係数のデータが集まれば、今度はそれをAIを用いて未知(未測定)の分子の拡散係数を予測することもできます。我々の最終目標は「高分子の分子構造」「拡散する分子の分子構造」の情報のみから適切に拡散係数を予測することのできるプラットフォームを構築することです。
まとめ & その他
拡散係数 D は、分子の摩擦係数 ξ の逆数 D=RT/ξ という側面もあり、粘度やモル電気伝導度などとも関係のある物性です。①~③を合わせて、移動物性に関するプラットフォームを整え、この物性をフルに活用できるデバイスを提案・設計し、社会に貢献していきます。
この他にも、何度でも再利用できる酵素の開発や様々な先端二次電池材料に関する研究も行っています。「研究内容」のページもご覧ください。
お問い合わせ
大橋 秀伯(Hidenori OHASHI)
東京農工大学 工学研究院 応用化学部門/工学部 化学物理工学科
〒184-8588 東京都小金井市中町2-24-16 工学部4号館3階318号
E-mail: ohashi![]() go.tuat.ac.jp (@は画像になっています)
go.tuat.ac.jp (@は画像になっています)