イオン液体の機能化
機能性zwitterionの開発
イオン液体を用いた自己組織化材料の開発
アミノ酸イオン液体:生体物質を起源とするイオン液体
温度により可逆的に相挙動を制御できる水/イオン液体二相系の設計
イオン液体を用いたバイオリファイナリー
イオン液体中のバイオリファイナリーの解析手法の開発
目的イオン種を含有するイオン液体
機能性zwitterionの開発
電解質材料としての展開
電池デバイスの安全性向上を目指し、イオン液体を電解液とした展開が注目されている。これはイオン液体が有する多々の特異な性質(難揮発性・難燃性・高イオン伝導性)に由来する。イオン液体を電解質として用いようと考えたとき、一つの大きな欠点として、イオン液体自身が電位勾配に応答して移動してしまうため、目的イオン(プロトンやリチウムイオン)の輸送が阻害されてしまう点が挙げられる。このような問題点を克服し、目的イオンを選択的に移動させるためには、イオン液体を構成するイオン自身の移動を抑制する必要があると考え、「イオン液体のカチオンとアニオンを共有結合により連結する」というアプローチを着想した。1分子全体で電気的に中和されていることから電場に応答しないマトリックスを得られるのではないかと考えた。種々のイミダゾリウムカチオンとスルホン酸アニオンを連結したzwitterion(双性イオン)を設計・合成したところ、それらのほとんどは融点が非常に高い(150℃以上)有機塩として得られた(J. Mater. Chem., 2001, 11, 1057. Link)。しかし、特筆すべきことに、これらのzwitterionにある種の無機塩や無機酸を添加すると物理化学的性質が大きく変わることを見出した。例えば、これらのzwitterionに等モルのLiTf2NまたはHTf2Nを添加すると室温で液体になる(Figure 1)(J. Mater. Chem., 2001, 11, 1057. Link, Chem. Commun., 2004, 1828. Link)。これは、HSAB則に従い、ソフトなイミダゾリウムカチオンとソフトなTf2Nアニオンが優先的に相互作用することで、ガラス転移点が低いイオンペアが形成されるためである。この液体を電解質として評価したところ、0.56という高いリチウムイオン輸率を示した(Electrochim. Acta, 2003, 48, 2079. Link)。Zwitterionのイオン構造と電気化学的性質の相関を系統的に整理した結果、現在までに0.69という極めて高いリチウムイオン輸率を示すzwitterion/リチウム塩複合体の開発に成功している(Chem. Commun., 2004, 2852. Link)。
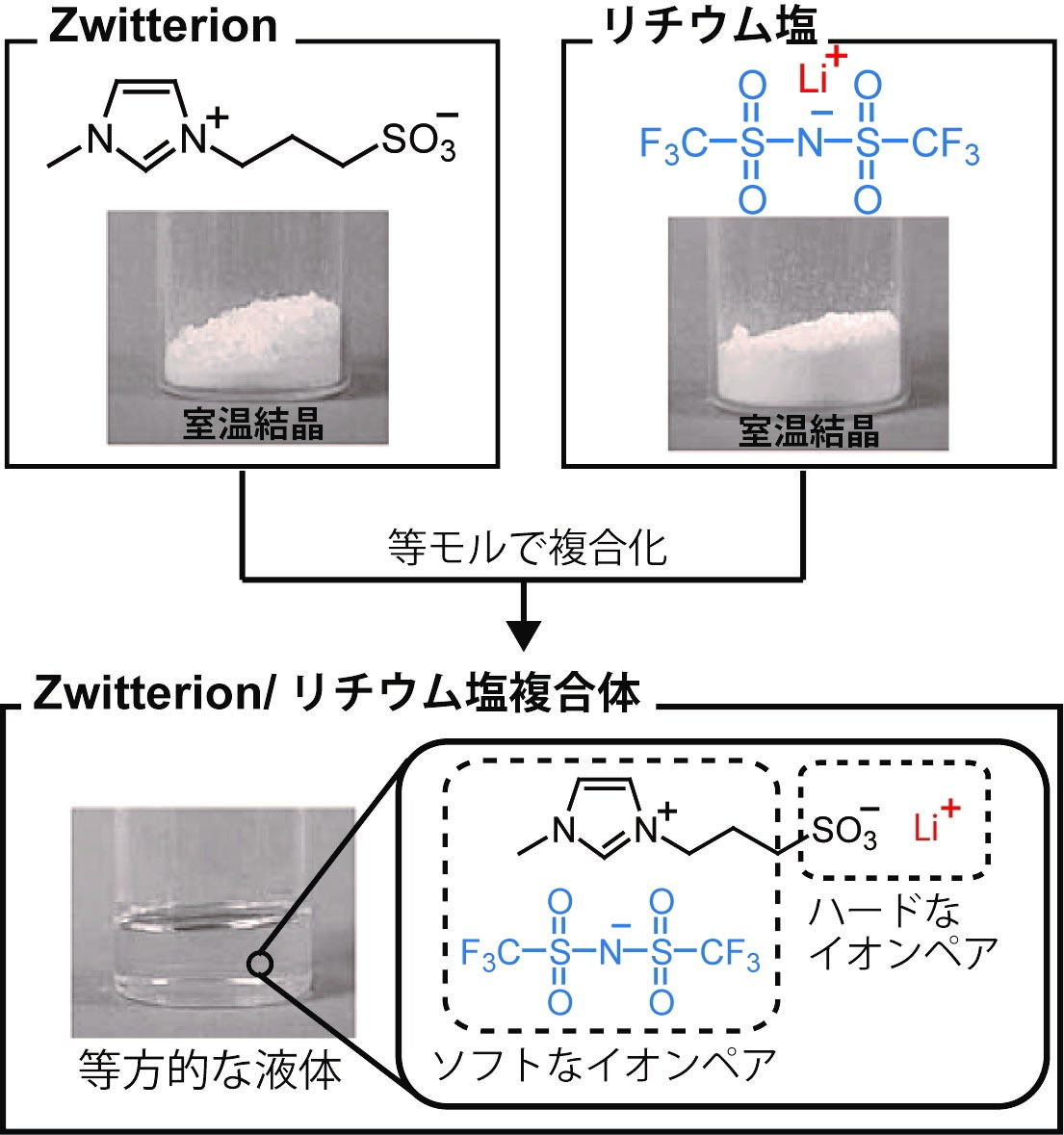
Figure 1. ZwitterionとLiTf2Nの混合
液晶性zwitterion
これまで我々はzwitterionに長鎖アルキル基を導入することで、種々の新規両親媒性分子を設計・合成してきた。これらの両親媒性zwitterionに酸を添加すると様々な液晶相を発現する。例えばFigure 2に示すホスホニウム塩型zwitterionとHTf2Nの等モル複合体は少量の水の存在下、カラムナー液晶相を発現し、一次元的な親水性チャンネルを形成する(Advanced Materials, 2011,23, 3071. Link)。一方、ピリジウム塩型zwitterionとHTf2Nの等モル複合体は三次元的な周期構造を有する双連続キュービック液晶相を発現し、三次元連続的な親水性界面を形成する(J. Am. Chem. Soc., 2012, 134, 11354. Link)。得られた親水性チャンネル及び界面は疎水的なイオン液体様のドメインに取り囲まれているため、これらの材料への少量の水を添加すると親水性チャンネルまたは界面に沿って水分子が連続的な水素結合ネットワークを形成し、それを通じたプロトンの高速な伝導を可能とする。
これらの両親媒性zwitterionの自己組織化挙動はリチウム塩の添加によっても同様に制御することが可能であることも見出している。特に、添加するリチウム塩の種類や割合によって相転移温度を連続的に変化させること・発現する液晶相をある程度コントロールすることが可能であることを明らかとしている。また、これらの両親媒性zwitterionをイオン液体と組み合わせることで、新しいリオトロピック液晶材料の開発にも取り組んでいる(Chem. Commun., 2012, 48, 5271. Link, RSC Advances, 2013, 3, 23222. Link)。
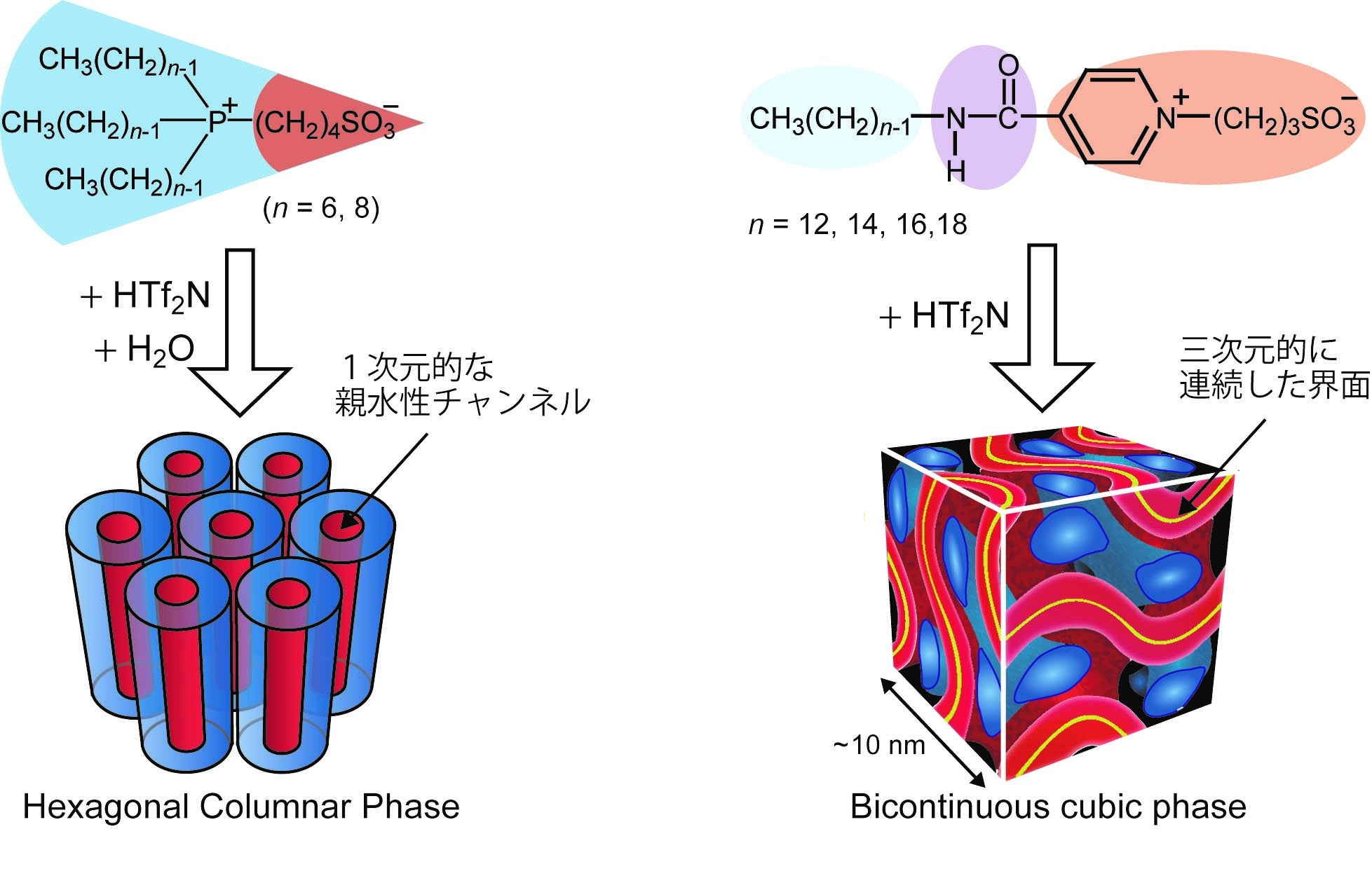
Figure 2. 両親媒性分子と酸(HTf2N)の混合による液晶相の発現
zwitterionの添加による疎水性イオン液体の含水率制御
水と油が混ざらないように、親和性が大きく異なる2種類の液体を混合すると相分離する。このようにして得られた液/液二相系は有用物質の分離・抽出場として幅広く利用されている。これまで我々は水とイオン液体の組み合わせから成る液-液二相系に着目して研究を進めている。このような水/イオン液体二相系を酵素反応場として用いることができればこれまでにないバイオマス処理システムの構築に繋がると考えている。このようなシステムの構築のためには、疎水性イオン液体中の含水率の制御が重要である。しかしながら、如何にイオン液体がデザイナーズソルベントと呼ばれようとも、イオン液体の飽和含水率をイオン構造のみでデザインするのは困難であり、含水率を連続的に制御する方法を考案する必要がある。緻密な性質制御を達成するに当たり、異種化合物同士の混合というアプローチを試みた。代表的な疎水性イオン液体である[C4mim][Tf2N]にzwitterionを添加すると飽和含水率が著しく変化することを報告している(Figure 3)。[C4mim][Tf2N]は疎水性の高いイオン液体であり、単独での飽和含水率は0.4 wt %程度である。しかしながらこのイオン液体にzwitterionを添加するとzwitterionの添加量の増大に伴い飽和含水率は上昇し、17.8 wt%まで任意に制御することができる(Int. J. Mol. Sci., 2013, 14, 18350. Link, Chem. Commun., 2012, 48, 11220. Link)。このようにして疎水性イオン液体の含水率を向上させることで、本来[C4mim][Tf2N]に不要なウマ心筋由来シトクロムcをバッファー中と同様の構造を保持したまま溶解することができる。イオン液体/水二相系の機能展開についてはこちらのページを参照されたい。
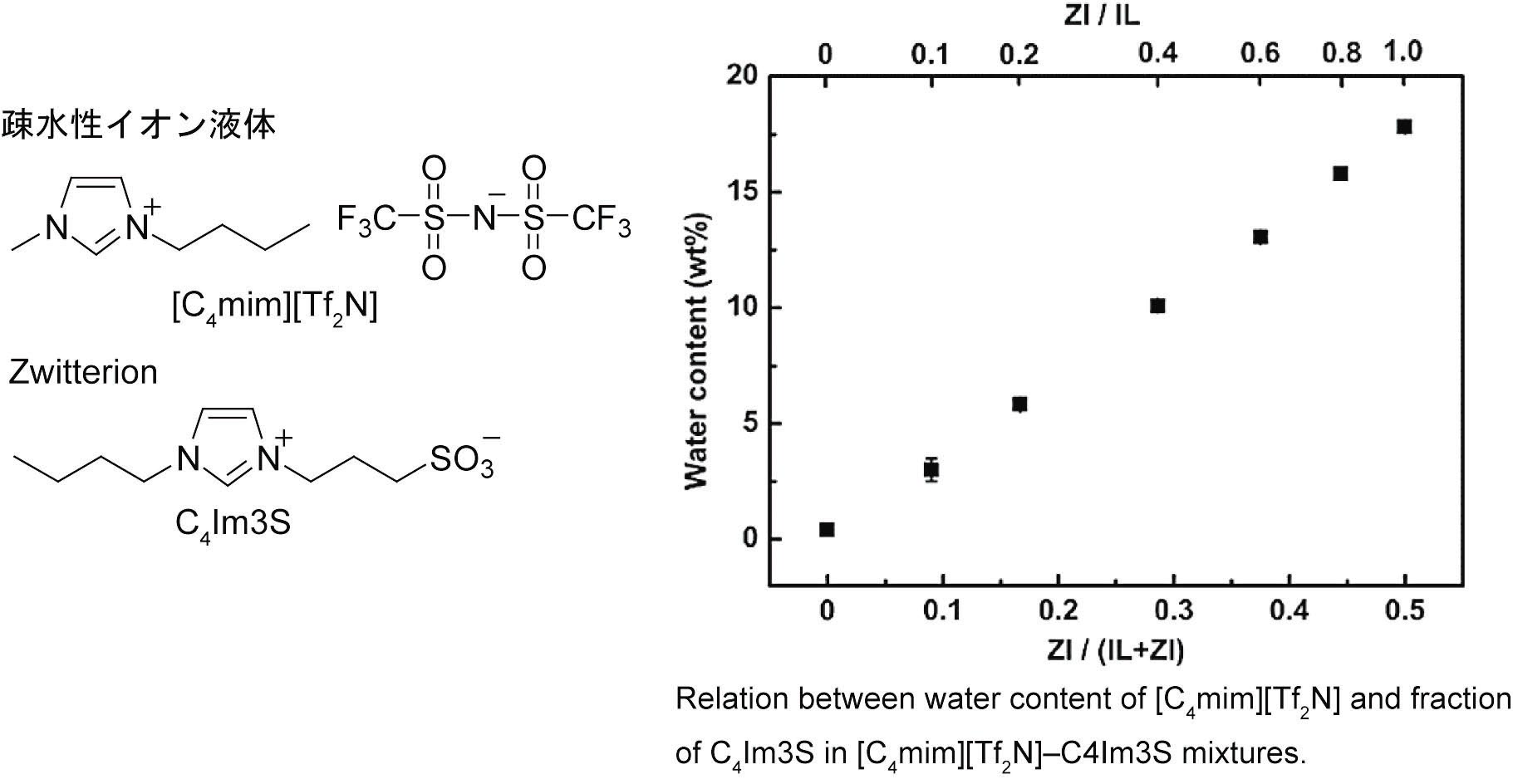
Figure 3. イオン液体へのZwitterion添加による飽和含水率の変化
イオン液体を用いた自己組織化材料の開発
一般的なイオン液体を構成するイオンは配向の秩序も位置の秩序も有していない。これらの一般的なイオン液体とは異なる挙動を示す有機塩群として、構成イオンの位置の秩序を有する柔粘性結晶(プラスチッククリスタル)および配向の秩序を有する液晶性イオン液体がある。液晶性イオン液体はイオン性液晶とも呼ばれ古くから研究されていたが、そのほとんどは、カチオンに長鎖アルキル基を一本有するイミダゾリウム塩・アンモニウム塩・ピリジニウム塩など分子構造が単純なものがほとんどであり、機能材料への展開はほとんど未開拓であった。我々の研究室では、東京大学の加藤研究室との共同研究のもと、これらの液晶性イオン液体を「イオン液体的な観点」及び「液晶的な観点」の二つの観点より設計し、多様なナノ相分離構造(ミセルキュービック相・カラムナー相・双連続キュービック相・スメクチック相)を発現する新しい液晶性イオン液体の開発に成功してきた。また、それらの機能展開(主に低次元イオン伝導材料)などへの応用展開にも成功しており、この分野において世界を先駆けてきた。我々のアプローチを二つに大別して以下に示す(Figure 4)。
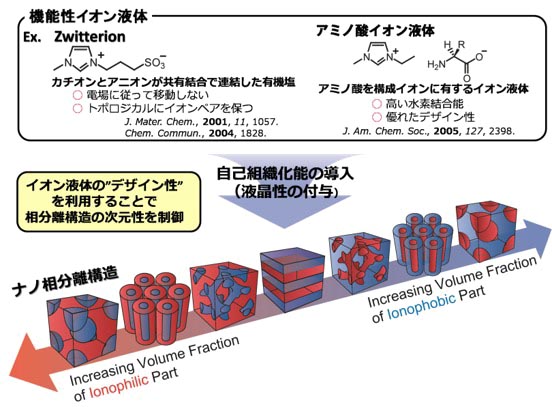
Figure 4. イオン液体を用いた自己組織化材料の開発
イオン液体の液晶化
イオン液体に自己組織化能を付与するには、疎イオン的な分子骨格をイオン液体に化学修飾する手法が有用である。例えば当研究室ではイミダゾリウム塩のスルホン酸アニオンに長鎖アルキル基を導入することでイオン性液晶性分子の開発に成功している(Chem. Commun., 2005, 1333. Link, Chem. Lett, 2004, 33, 1630. Link)。この分子は、イオン性のレイヤーと疎イオン性のレイヤーが相互に積層したスメクチック液晶相を形成する。イオン性のレイヤーがイオン伝導パスとして機能し、疎イオン性のレイヤーはイオンの絶縁層として振る舞うため、この液晶材料に電位を印加すると二次元的なイオン伝導挙動が観測される。このような材料設計は異方的イオン伝導材料の開発に繋がる。また、イオン性液晶分子を適切にデザインすることでシリンダー状のカラムナー構造やジャイロイド構造を有する双連続キュービック構造を形成することもできる。これらの液晶材料についても、分子集合構造由来のユニークなイオン伝導挙動を示すことが見出されている。
イオン液体を溶媒としたリオトロピック液晶
ある種の両親媒性分子や化合物は溶媒の存在下で自己組織化し液晶性を示すことがある。このように溶媒の添加により誘起される液晶材料を総称してリオトロピック液晶と呼ぶ。イオン液体は一般的な分子溶媒にはない物性を多々有しているため、近年、イオン液体を溶媒としたリオトロピック液晶の開発が注目され始めている。
水中における両親媒性分子の自己組織化には、水分子の高い水素結合能が大きく関与していることが明らかとされてきた。このような知見の基、イオン液体の水素結合能を自在にコントロールすることができれば、両親媒性分子の自己組織化挙動を劇的に変化させることができのではないかと着想した。これまで我々は多様なイオン液体をデザイン・開発し、それらの水素結合能をKamlet-Taftパラメータによって評価してきた。多々のイオン液体群の中でも、我々が開発した天然アミノ酸をアニオンに有するアミノ酸イオン液体が高い水素結合能を有しているイオン液体であった。また、アミノ酸イオン液体のアニオンを選択することでその物理化学的性質を簡便に調整することが可能であるという点もアミノ酸イオン液体の特徴である。これらの特徴を生かし、アミノ酸イオン液体をリオトロピック液晶の溶媒として利用できれば、溶媒のデザインによって両親媒性分子の自己組織化挙動を制御できる材料の構築につながると考えた。一般的に、両親媒性分子の自己組織化は、両親媒性分子の分子設計・溶媒の添加割合・温度などのパラメータによって制御するのが一般的であるが、アミノ酸イオン液体の利用は「溶媒のデザインによって両親媒性分子の自己組織化挙動の制御」を可能とし、新たなパラメータとなりうることを明らかとした(Figure 5)(Chem. Comm., 2013, 49, 11746. Link)。
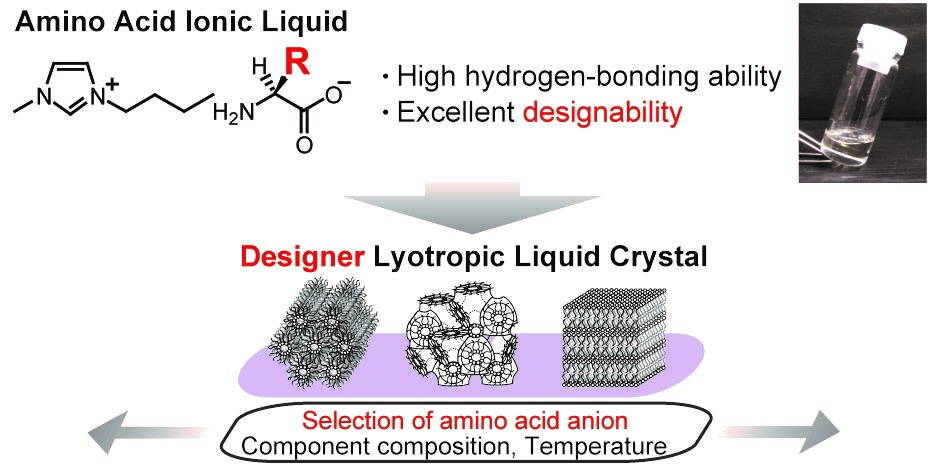
Figure 5. アミノ酸イオン液体を溶媒とした液晶相の発現
アミノ酸イオン液体:生体物質を起源とするイオン液体
イオン液体は有機イオンから形成できるため、無限ともいえる数のイオン種を対象にすることができる。もちろん生体物質由来のイオンも例外ではなく、我々の体を形成しているたんぱく質の基本単位であるアミノ酸も構成イオンに用いることができる。Na+やK+などのアルカリ金属カチオンとアミノ酸からなるアミノ酸塩は200℃以上の融点を示す固体である。しかし、イミダゾリウムカチオンなどの適当な有機カチオンと組み合わせると、室温で液体のイオン液体が得られる。1-エチル-3-メチルイミダゾリウムカチオンと20種類の天然アミノ酸との組み合わせから得られた塩は全て室温で液体となり、イオン液体ということが確認された(Figure 6)この研究はChemical & Engineering NewsやLetters in Organic ChemistryのNews欄で最新トピックスとして取り上げられた。

Figure 6. タンパク質を構成する20種類のアミノ酸を出発物質とするイオン液体
また、アミノ酸は同一炭素原子上にアミノ基とカルボキシル基を有する両性分子なので、イオン液体のカチオン及びアニオンとすることが可能である。さらに、アミノ基やカルボキシル基以外の官能基をも側鎖に有していることから、一般的なイオン液体には無い機能付与も行うことができる。図に示したアミノ酸イオン液体は、アミノ酸アニオンの側鎖構造の違いによって粘度やガラス転移温度などが大きく異なることが明らかにされている。このことから、イオン液体の構成イオン種が有する官能基が物性にどのように影響するのかを検討することができる。
イミダゾリウムカチオンの代わりに、テトラブチルホスホニウムカチオンを用いてアミノ酸と塩形成させることで、より低粘性で、高い熱安定性を示すアミノ酸イオン液体が得られている。このイオン液体は樹脂用の触媒として工業的に利用されているテトラブチルホスホニウムハイドロキシドとアミノ酸を混ぜて水を除くだけという非常に簡単な方法で得られるので、高純度かつ安価なイオン液体を大量に供給することが可能である。アミノ酸イオン液体は光学活性で、極性もかなり大きいので、反応溶媒としても興味深い。さらに生体由来のカチオンを用いることで、構成イオンすべてが生体物質を起源とするイオン液体(食べられるかも!!)や、アミノ酸を化学修飾して機能を導入すれば、目的の機能を持った光学活性なイオン液体の創出なども可能となる。生体分子をイオン液体の出発物質に用いることで、生物化学や食品、医療などの分野に貢献できる新しいイオン液体をデザインすることも不可能ではない。
温度により可逆的に相挙動を制御できる水/イオン液体二相系の設計
水に油を注ぐと互いに混じり合わないため相分離する。このような状態を「液-液二相系」と言い、化学反応場や化合物を分離・抽出するプロセスとして工業的にも用いられている。水と混ざらない有機溶媒は、引火性や環境汚染、さらには人体への悪影響など様々な問題を抱えており、使用が禁止あるいは制限されている。そのため、蒸気圧の高い有機溶媒を用いない二相系が求められている。イオン液体は塩であるため水と混ざりやすいと思われがちだが、水と混ざらないイオン液体も多く存在する。これらは疎水性イオン液体と呼ばれている。アルキル鎖が長いカチオンや電子が非局在化したアニオンなどが構成イオンであると、疎水性イオン液体になりやすいことが報告されている。
我々はイオン液体のイオン構造の設計を通じ、様々なイオン液体/水二相系を提案してきた。例えば水と低温では相溶し、高温では相分離する下限臨界溶解温度(LCST)を示すイオン液体である(Figure 7 左)。LCST挙動を示すイオン液体/水二相系は室温近傍の僅かな温度変化で「一相⇔二相」を制御できるため、化合物の反応溶媒や分離抽出溶媒としての応用が期待できる。我々はイオン液体と水に関する膨大な基礎知見を整理することで、水とLCST挙動を示すイオン液体を作製するためには「カチオンとアニオンのトータルの疎水性」が重要であることを明らかにした。通常は温度に依存せず液-液相分離する疎水性イオン液体もしくは相溶する親水性イオン液体であるが、「カチオンとアニオンのトータルの疎水性」をこの間のある領域になるようにイオン構造を設計すると水とLCST挙動を示すイオン液体が作製できる(Figure 7 右)。
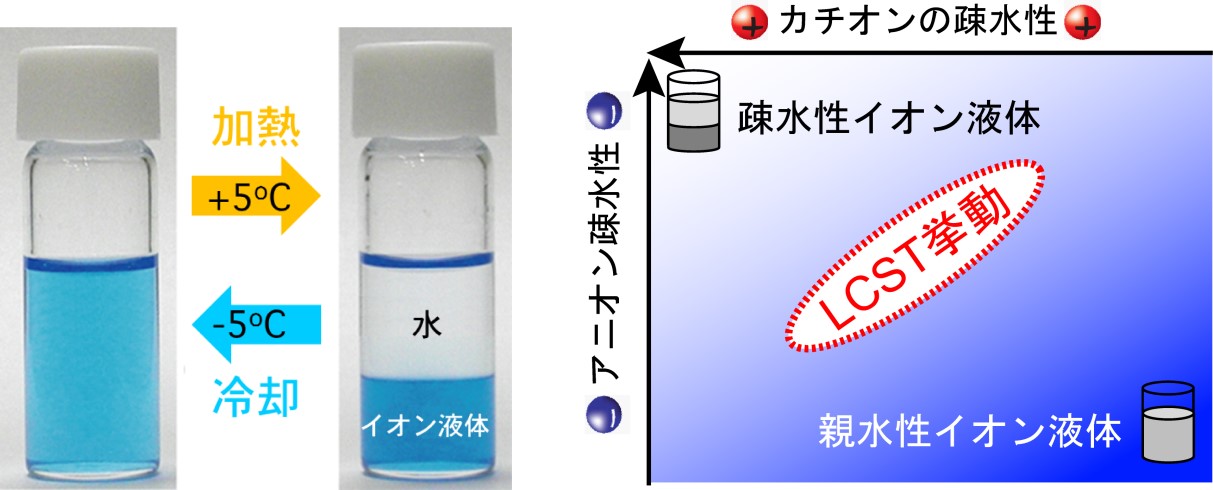
Figure 7. LCST挙動を示すイオン液体/水混合系
一般的に液-液界面(液体と液体の境界面)の物質移動は非常に遅いが、LCST挙動を示すイオン液体/水二相系を用いれば水との界面を一時的に消すことができ、化合物の分離・抽出を瞬時に行うことができる。この特徴は、環境変化に弱いタンパク質の分離抽出溶媒として有用であると考えた。始めにモデルタンパク質としてウマ心筋由来Cytochrome c(Cyt.c)の分配を検討したところ、相分離後ほぼ完全にイオン液体相にCyt.cが分配された。一方、ブルー銅タンパク質の一種であるAzurineで同様の検討を行ったところ、相分離後ほぼ完全にAzurineは水相に分配された。そこで、Cyt.cとAzurineの混合溶液からそれぞれのタンパク質の分離を試みた。その結果、LCST挙動を経由させることで、2種類の水溶性タンパク質を分離することに成功した(Figure 8)。将来的には一相の状態で酵素反応を行い、少し昇温することで目的物のみを水相を抽出し、イオン液体相の酵素を再利用できる環境調和型システムの構築を目指す。

Figure 8. LCST挙動を利用したタンパク質の分離
イオン液体を用いたバイオリファイナリー
イオン液体の構造デザインの可能性が豊富で様々な性質を制御できるという特性を活かし、従来の溶媒には溶けにくい物質を溶かすイオン液体の研究が盛んに行われている。中でも、植物バイオマスの主要構成成分であるセルロースの溶解は大きなテーマである。植物バイオマスは地球上に多量に存在し、再生可能資源としての利用が期待されている。しかし、セルロースなどの多糖類成分は一般的な溶媒に溶けにくく、これが植物バイオマスの利用を著しく制限している。
当研究室では、セルロースなどの難溶性多糖類を溶かすイオン液体の開発、及びイオン液体を用いた植物バイオマスの成分分離や有用成分の抽出を検討している。イオン液体の構造と物理化学的性質の関係、及びセルロース溶解能の有無を幅広く精査した結果、イミダゾリウムカチオンと亜リン酸アニオンからなる高極性イオン液体が非加熱でもセルロースを溶かせることを見出した(Figure 9)(Green Chem., 2008, 10, 44. Link)。さらに、植物バイオマスからの有用多糖類の抽出にも挑戦し、非加熱での小麦外皮の溶解、及びセルロースなどの多糖類成分の抽出に成功した(Green Chem., 2010, 12, 1280. Link)。
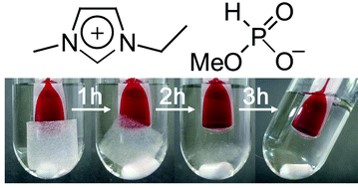
Figure 9. 高極性イオン液体を用いたセルロースの溶解
さらに、セルロースの溶解だけでなく、新たな機能を付与したイオン液体の開発にも着手している。上述のイオン液体は優れた溶媒であるが、少量の水が混ざるとセルロース溶解能を失う。そのため、セルロースや植物バイオマスを溶かす前に、イオン液体及びバイオマスを乾燥させなければならず、溶解プロセス自体も乾燥した密閉空間で行う必要があった。そこで我々は、含水条件下でも働くイオン液体(誘導体)としてアルキルホスホニウムカチオンを有する水酸化物を見出し、多量の水存在下でセルロース及び植物バイオマスを溶かすことに成功している(Chem. Commun., 2012, 48, 1808. Link)。また我々は、「疎水性かつ高極性」という一見相反する特性を有するイオン液体の開発にも挑戦している。長鎖アルキル基を有するホスホニウムカチオンと亜リン酸アニオンを組み合わせたイオン液体が高極性であるにも関わらず、水と相分離することを明らかにした(Phys. Chem. Chem. Phys., 2013, 15, 4066. Link)。現在は、このイオン液体相へのセルロースの溶解と、加水分解(水は水相から供給される)、二相系を利用した分解生成物の回収について検討している。
また、項極性イオン液体は、多糖類以外の有用成分の回収にも威力を発揮する。我々は、微細藻類が生産したPoly(3-hydroxybutyrate)(PHB; 生分解性プラスチック)の抽出プロセスでセルロース溶解能を有するイオン液体を用いることで、含塩湿潤状態の藻体の植物細胞壁を溶解してPHBを残差として回収することに成功した(Enzyme and Microbial Tech., 2013, 52, 199. Link)。他の有用物質についても、回収及び単離・精製プロセスの構築を試みている。
イオン液体中のバイオリファイナリーの解析手法の開発
前項で挙げたとおり、イオン液体はセルロース系バイオマスのエネルギー変換用の溶媒として注目されている。しかしながら、セルロースは通常の溶媒に溶解できないため、イオン液体中のエネルギー変換の過程(抽出・加水分解)を解析することは難しかった。抽出のメカニズムや加水分解反応の反応機構などを基礎から解析することができれば、より効率よくバイオマスをエネルギー変換するための改善策へとつながる。そこで我々は、イオン液体を様々な解析システムへと適用し、解析手法を開発した。
解析の溶媒に最適なイオン液体の探索
解析システムへとイオン液体へと適用するときには、イオン液体の粘度が最も大きな障害であった。そこで我々ははじめに粘性の低いイオン液体を探索した。クロライドアニオンを有するイオン液体(1 in Figure 10)の粘度(過冷却状態)は水の10000倍以上である。さまざまなイオン液体の物性を検討したところ、カルボン酸系アニオンと亜リン酸系アニオンを有するイオン液体(2,3 in Figure 10)の粘性が1と比較して100分の1程度だった。さらに安定性・融点の観点では、亜リン酸系アニオンを有するイオン液体が優れていたことから、次の解析手法への適用を試みた。
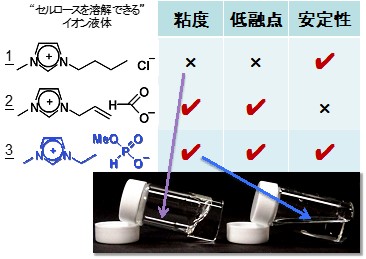
Figure 10. イオン液体の種類と物性
1H NMRを用いたセルロース抽出機構の解析
これまでイオン液体の高い粘性に加えて、イオン液体の重水素化の難しさ、ポリマーの1Hシグナルの観測の難しさ(シグナルのブロード化)からセルロースの1H NMRシグナルを測定した例はなかった。イオン液体の重水素化は、重水素化せずに磁場を安定させるNo-D NMR法および巨大な溶媒(イオン液体)由来のシグナルを消去するWET法を組み合わせることで回避できた。さらに、イオン液体の特徴である不揮発性を利用して100 ℃まで加熱することにより、シグナルの観測に成功した。さらに貧溶媒を加えながら、シグナルのシフトを詳細に解析することでイオン液体と6位のOH基との相互作用が、溶解に重要であることをはじめて実験的に証明した(Figure 11)。
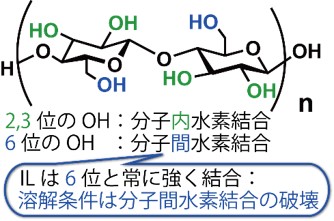
Figure 11. イオン液体中へのセルロースの溶解メカニズム
イオン液体を移動相とするHPLC(HPILC) によるセルロースの加水分解反応の解析
HPLCのカラムは非常に高い圧力がかかるため、リン酸系イオン液体を適用し、さらにカラムを55 ℃まで上昇させ、流速を0.01 ml/minという超低流速にすることによって通液を可能とした。そのシステムを用いて由来の異なるセルロースの分子量・分子量分布を明らかにした。(Chem. Commun., 2011, 47, 1994. Link)。さらに、酵素反応および超音波によって分解したセルロースを測定した。酵素反応の場合は低分子量側にピークが観測され、選択的加水分解反応が観測された(Figure 12 青)。超音波の場合は、ピークがブロードになりながらシフトし、ランダムな分解が確認された(Figure 12 赤)。それらの結果から、単純に加水分解反応の効率を見積もるだけではなく、イオン液体中のセルロースの加水分解反応メカニズムを解析するための手段として有用であることが分かった(Anal. Methods, 2013, 5, 3172. Link)。
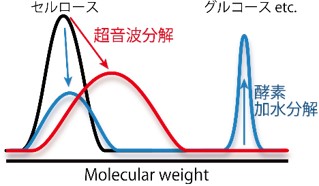
Figure 12. 加水分解手法の違いによる分子量分布変化の違い
目的イオン種を含有するイオン液体
我々はイオン液体の電解質としての応用も試みている。イオン液体は一般の溶媒では達成できない高いイオン密度を有し、かつイオン移動度も大きいため、優れたイオン伝導度を示す。しかしながら、一般的なイオン液体単体では電池の電解質として利用することはできない。例えば、リチウムイオン電池ではリチウムイオンがキャリアイオンとして電解質中を伝導することで充放電が促されるため、イオン液体単体では電解質として機能できない。イオン液体に目的イオン種を含有させるには、解離して目的イオン種を生成する塩(例えば、LiCl->Li+ + Cl-)をイオン液体に溶解させること一つの方法として挙げられる。しかし、LiClのような固体塩をイオン液体へ高濃度で溶解させることは難しく、溶解できたとしても粘性の増大やイオン伝導度の低下が引き起こされるといった問題があった。
リチウムイオンを含む塩の多くは室温で固体であるが、リチウムイオンを構成成分とするイオン液体をデザインすることができれば、低粘性かつ高イオン伝導性の電解質を設計できる。我々の研究室ではこれまでに、極性高分子の末端にリチウム塩構造を導入することで室温で液状のリチウム塩の設計を行ってきた。電荷が高度に非局在化したアニオンから成るリチウム塩を採用することで、塩の融点を大幅に低下でき、室温で液状のリチウム塩の設計に成功した。さらに、イオン液体の構成イオンとして多価アニオンを用いることでリチウムイオンを含むイオン液体を作製することに成功した(Figure 13)。
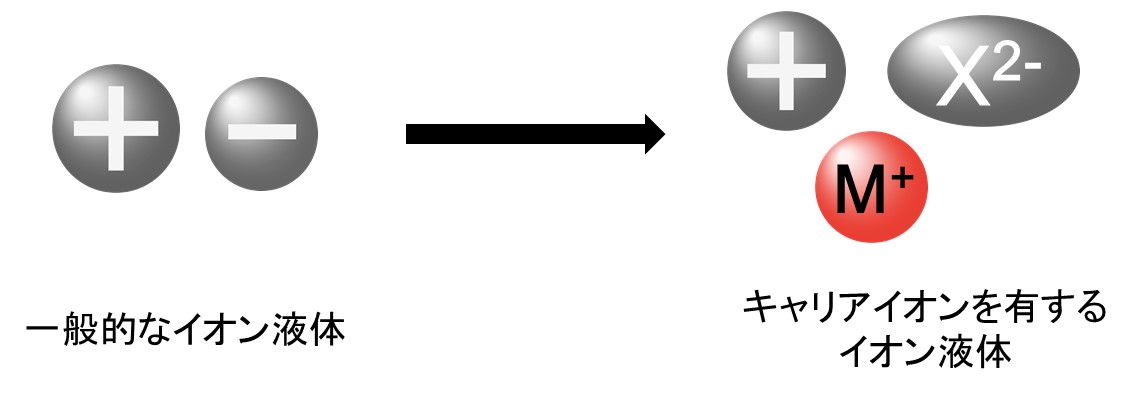
Figure 13. 電池の充放電に寄与するキャリアイオンを有するイオン液体
このイオン液体は、リチウムイオン以外にも、ナトリウムイオンやカリウムイオンを用いた場合にも室温で液状になる。リチウムイオン電池に限らず、様々な電気化学デバイスが必要とするキャリアイオン種を高濃度に含有し、なおかつ低粘性(高イオン伝導性)なこのイオン液体は、リチウムイオン電池を始めとして様々なデバイスの電解液としての利用が期待できる。

