黒田研究室は2004年に設立しました。生物学と生物情報科学・生物物理化学の境界領域として、タンパク質が関係する生命現象を原子・分子レベルで解明することと、その知識をバイオ産業及び創薬研究へ応用することを目指しています。 15から20名ほどの卒研生、大学院生、博士研究員、産学連携研究員などが力を合わせ、自由・活発な議論を交わしながら論理的な考えに基づいて、タンパク質や酵素の物性や構造の解析・設計をし、サブユニットワクチンの設計、タンパク質凝集が引き起こす免疫応答の解析や制御、がん細胞増殖抑制抗体断片の研究に日々励んでいます。
タンパク質の溶解性、凝集性の制御
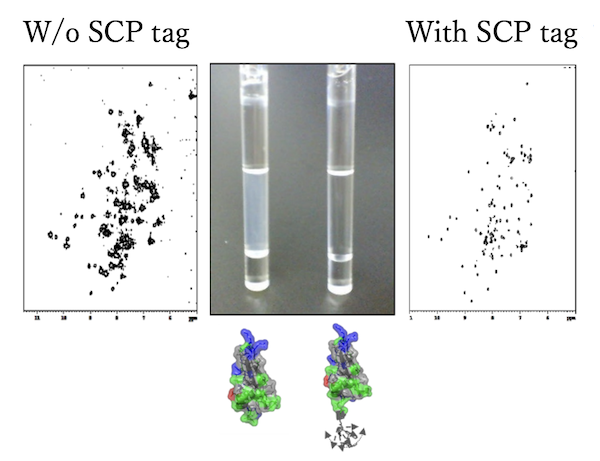
目的タンパク質の機能や構造を変えずに溶解性又は凝集性を制御するための技術を開発しています。本技術は、溶解性が低いタンパク質の末端に数残基の親水性アミノ酸を遺伝子工学的に付加するという簡単な発想に基づいています。 数残基の親水性アミノ酸からなるペプチドを末端に付加するのみである本技術をSEPタグ(溶解性向上ペプチドタグ:Solubility Enhancement Peptide tag)又はSCPタグ(溶解性制御ペプチドタグ:Solubility Controlling Peptide tag)と命名しました。また、SEPタグの構成アミノ酸に親水性ではなく疎水性アミノ酸を用いること、溶解性を下げ、10~1000ナノメータの会合体を形成させる技術も開発中です。従来の溶解性を向上させる技術と比べてSEP及びSCPタグは以下の特長を有しています。
- 溶媒調整が不要なため、試験管内では勿論、細胞内でも使用可能です。特に大腸菌などで組換えタンパク質を天然状態で精製するために有利な技術です。
- 組換えタンパク質の精製によく用いられるTEV(Tobacco Edge Virus)酵素の溶解性を向上出来ます。その結果、市販TEVより広条件下で使用可能なスーパーTEV酵素が完成しました。ADDGENE
- 海ほたる(ガウシア)由来の発光酵素であるルシフェラーゼ(GLuc)の溶解性を向上させることで、大腸菌から組換えルシフェラーゼを精製することが可能になりました。従来の発現系では、4本のSS結合がGLucの巻き戻りを阻み大腸菌での発現は不可能と思われていましたので、昆虫細胞を使用していました。SEPタグを付加したGLucは従来のものより格段に安価で短時間の精製が可能になりました。ADDGENE
- 現在は、ScFvという抗体断片の可溶化を進めています。
- SEPタグは、分子量数千のペプチドから5万程のタンパク質まで、ほとんどのタンパク質に効果が見られる汎用的な技術です。
- Wu Nan, Saotome Tomonori, Unzai Satoru, Kuroda Yutaka* and Yamazaki Toshio *, Solution structure of Gaussia Luciferase with five disulfide bonds and identification of a putative coelenterazine binding cavity by heteronuclear NMR, Scientific Reports volume 10, Article number: 20069 (2020)
- Nautiyal Kalpana and Kuroda Yutaka, A SEP tag enhances the expression, solubility and yield of recombinant TEV protease without altering its activity, N Biotechnol.; 42:77-84 (2018)
- Kato Atsushi, Maki Kosuke, Ebina Teppei, Kuwajima Kunihiro, Soda Kunitsugu and Kuroda Yutaka*, Mutational analysis of protein solubility enhancement using short peptide tags, Biopolymers, 85:12-18 (2007)
- 特許第5273438号: 黒田裕、泉川直重、加藤淳、惣谷志保里、"ペプチドの溶解度計算方法、及びそれを用いたペプチドタグの設計方法とタンパク質の合成方法"、平成20(2008)年1月11日出願、登録日:平成25(2013)年5月24日、特許出願人:国立大学法人東京農工大学
タンパク質凝集の生物学的・生理学的影響
近年、タンパク質凝集による神経変性疾病以外の生理学的影響が明らかになりつつあります。我々は、分子量が小さい免疫原性の低いタンパク質が凝集することで強い免疫応答を引き起こすことを解明しました。凝集は強い免疫応答を突発的に誘導する因子であることが、創薬タンパク質における臨床報告により以前から推定されてきました(FDA Guidance, 2014)。しかし、凝集性と免疫原性の関係を直接的に証明する実験は未だ殆どなされていません。理由はいくつかありますが、不定形な凝集(会合)の物性の研究があまり進められていないことや、タンパク質を意図した状態に会合させる技術が開発されていないという点が挙げられます。 そこで、我々はSCPタグを用いることでタンパク質を意図した大きさ・物性を有する会合体に会合させることによって、タンパク質の免疫原性を増強させ、増強メカニズムを解明し、免疫原性の制御を可能にするための研究を進めています。さらに、現在では、ウイルス由来の組換えタンパク質を大腸菌で発現し、それをサブユニットワクチンのシーズに応用する研究を進めています。サブユニットワクチン開発研究においても組換えタンパク質の免疫原性が低いことが課題となります。そこで、我々はSCPタグを用いてウイルス由来の組換タンパク質の免疫原性を増強することによって、ワクチンへの適合性を高めるという独自技術の開発を進めています。
- Subbaian Brindha and Kuroda Yutaka, A Multi-Disulfide Receptor-Binding Domain (RBD) of the SARS-CoV-2 Spike Protein Expressed in E. coli Using a SEP-Tag Produces Antisera Interacting with the Mammalian Cell Expressed Spike (S1) Protein. Int. J. Mol. Sci. 23, 1703 (2022)
- Golam Kibria M., Akazawa-Ogawa Y, Hagihara Y, Kuroda Y. *, Immune response with long-term memory triggered by amorphous aggregates of misfolded anti-EGFR VHH-7D12 is directed against the native VHH-7D12 as well as the framework of the analogous VHH-9G8..Eur J Pharm Biopharm. 7: S0939-6411(21) 00128-4(2021)
- Rahman N, Islam MM, Unzai S, Miura S, Kuroda Y., Nanometer-size aggregates generated using short Solubility Controlling Peptide tags do increase the in vivo immunogenicity of a non-immunogenic protein., Mol Pharm. 2020 Mar 31. May 4;17 (5):1629-1637
- Islam MM, Miura Shiho, Hasan MN., Rahman Nafsoon, Kuroda Yutaka*, Anti-Dengue ED3 long-term immune response with T-cell memory generated using Solubility Controlling Peptide tags, Frontiers in Immunology, 2020, Mar 17;11:333
バイオインフォマティクス:タンパク質の溶解性予測
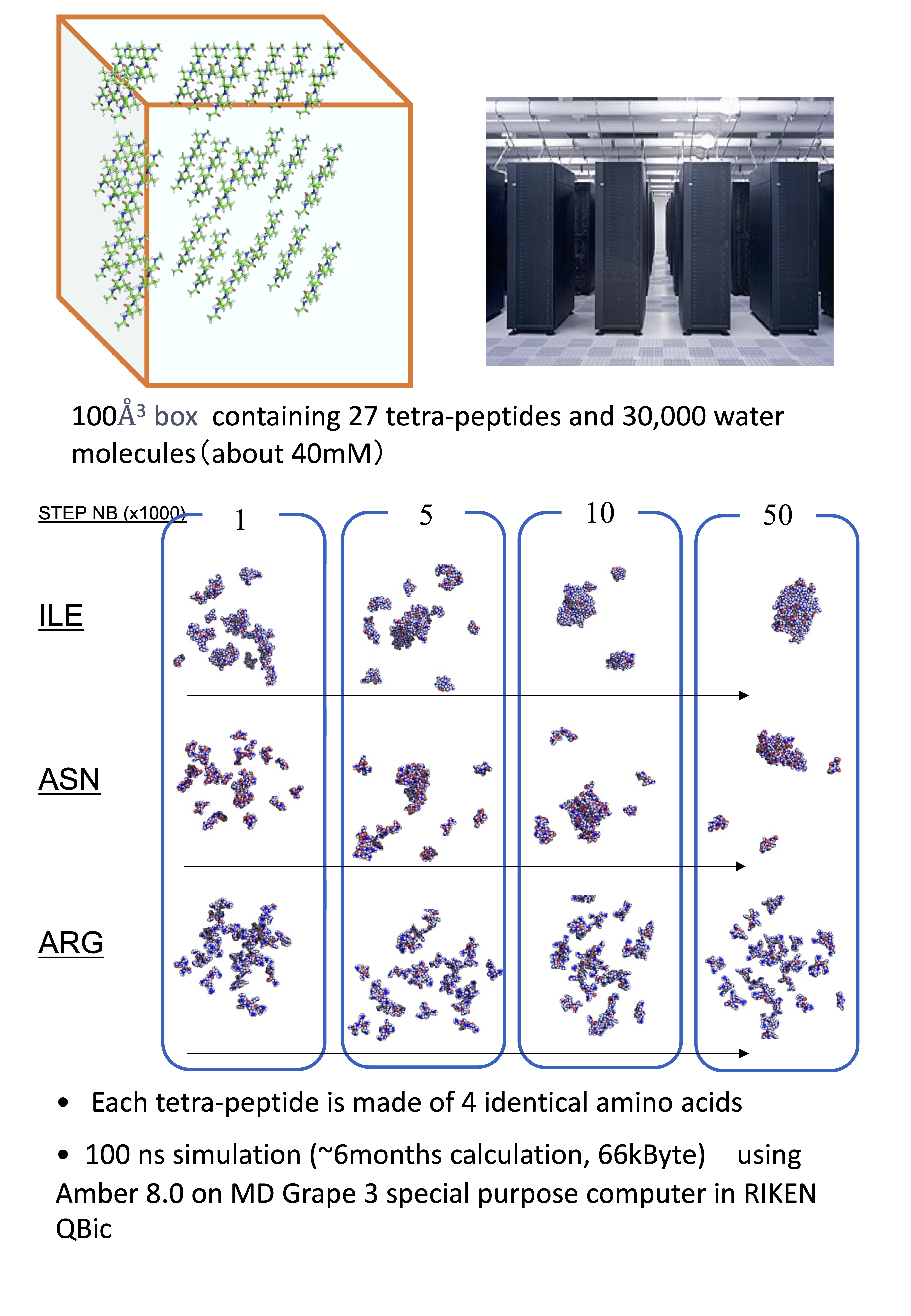
最近まで非アミロイド凝集や会合体の物性はあまり研究されていませんでした。しかし最近の研究で、不定形(アモルファス)凝集が生理学的機能に影響するということが分かってきました。本研究室では、バイオインフォマティクス手法を用いて、分子動力学法、ブラウン分子力学法や格子モデル法とモンテカルロ法を使用して、タンパク質やペプチドの凝集の形成を計算機内で再現できるか否かを調べています。 最近では、MD-GRAPEスーパーコンピューターを使用した理化学研究所との共同研究で、アミノ酸の溶解性を再現できることを検証しました。上記TEV酵素の溶解性設計にはブラウン分子力学法を用いています。
- Tambi Richa, Morimoto Gentaro, Kosuda Satoshi, Taiji Makoto, Kuroda Yutaka*, Large-scale all-atom molecular dynamics alanine-scanning of IAPP octapeptides provides insights into the molecular determinants of amyloidogenicity, Scientific Reports, 9(1):2530 (2019)
- Kuroda Yutaka*, Suenaga Atsushi, Sato Yuji, Kosuda Satoshi and Taiji Makoto, All-atom molecular dynamics analysis of multi-peptide systems reproduces peptide solubility in line with experimental observations, Scientific Reports 6, Article number: 19479 (2016 Jan28)
- Nautiyal Kalpana, Kibria Md Golam, Ogawa-Akazawa Yoko, Hagihara Yoshihisa, Kuroda Yutaka*, Design and assessment of an active anti-epidermal growth factor receptor (EGFR) single chain variable fragment (ScFv) with improved solubility, Biochemical and Biophysical Research Communications: 508(4):1043-1049 (2019
- 特許第5273438、黒田 裕、泉川 直重、加藤 淳、惣谷 志保里、"ペプチドの溶解度計算方法、及びそれを用いたペプチドタグの設計方法とタンパク質の合成方法"、平成20(2008)年1月11日出願、登録日 平成25(2013)年5月24日
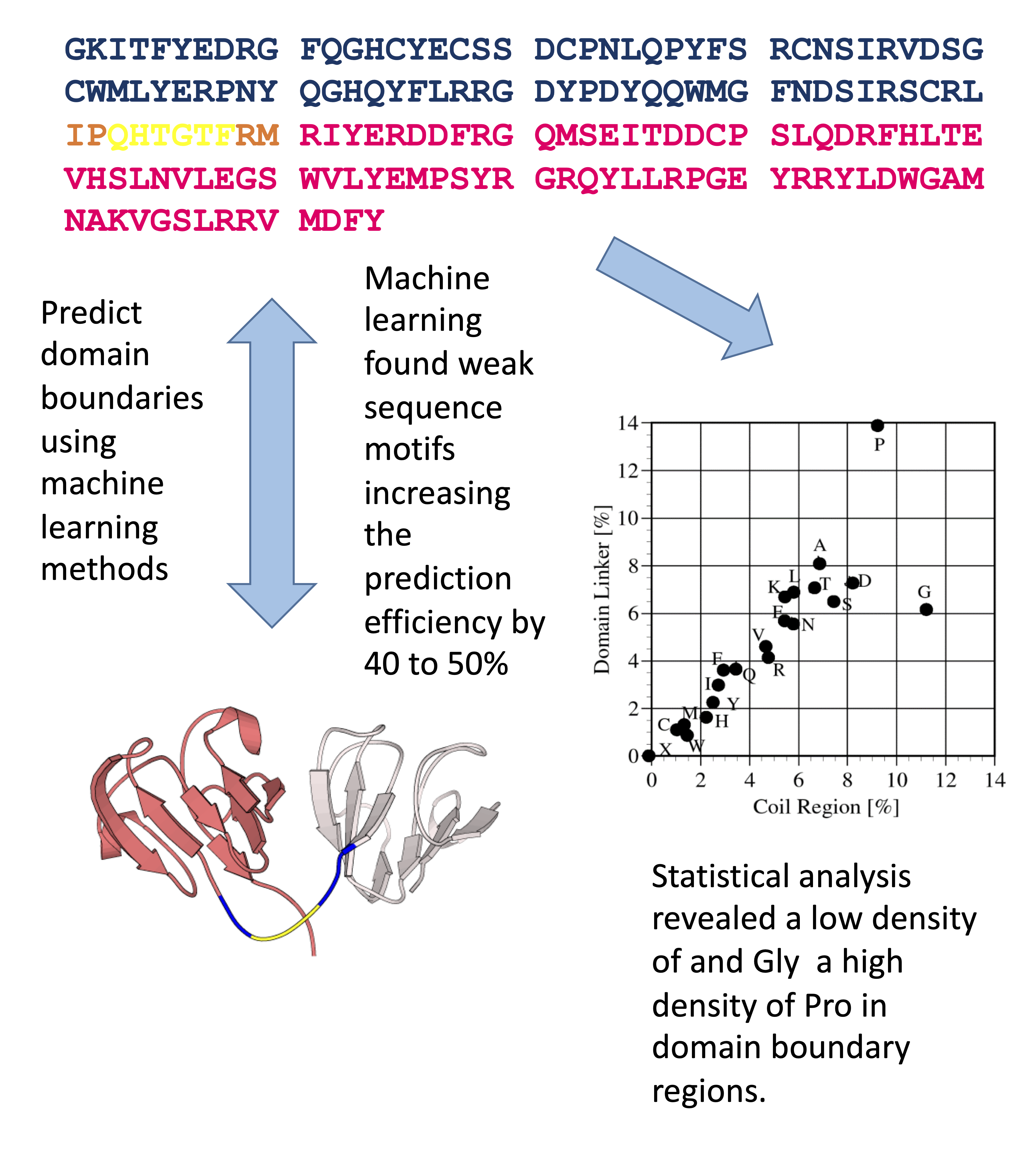
機械学習を用いたタンパク質のドメイン境界予測
AIを使用する2つ目の研究テーマとして、蛋白質ドメインを配列から予測する研究を行っています。 単独で生物機能を発現できるドメイン領域は、タンパク質の重要な基本単位です。アミノ酸配列からドメイン領域を予測する方法は、タンパク質の迅速な解析が可能なドメイン単位に分割する手法を提供することから、プロテオームの網羅的解析に必須な手法です。本研究室では、新規タンパク質のドメイン領域をアミノ酸配列情報から高効率に同定するサポートベクターマシン(SVMの一種)を開発し、インターネットで公開しています。 本予測機の的中率は60%近くあり、CASP8(国際蛋白質構造予測コンテスト、2009年実施)のドメイン予測部門でも1位となったことから、当時博士課程2年生の蝦名君が東京農工大学学生表彰を受賞しました。
- Tambi Richa, Ide Shoichi, Ebina Teppei, Kuroda Yutaka, Fast H-DROP: A thirty times accelerated version of H-DROP for interactive SVM-based prediction of helical domain linkers", Journal of Computer-Aided Molecular Design (2):237-244 (2017)
- Ebina Teppei, Toh Hiroyuki, Kuroda Yutaka*, DROP: an SVM domain linker predictor trained with optimal features selected by random forest, Bioinformatics, 27(4):487-94 (2011)
- 特許第4213034号、黒田 裕、宮崎 哲、田中 隆則、横山 茂之、"タンパク質のドメインリンカーを予測する方法"、特願2003-538962、平成14 (2001) 9月25日出願、特許出願人:理化学研究所
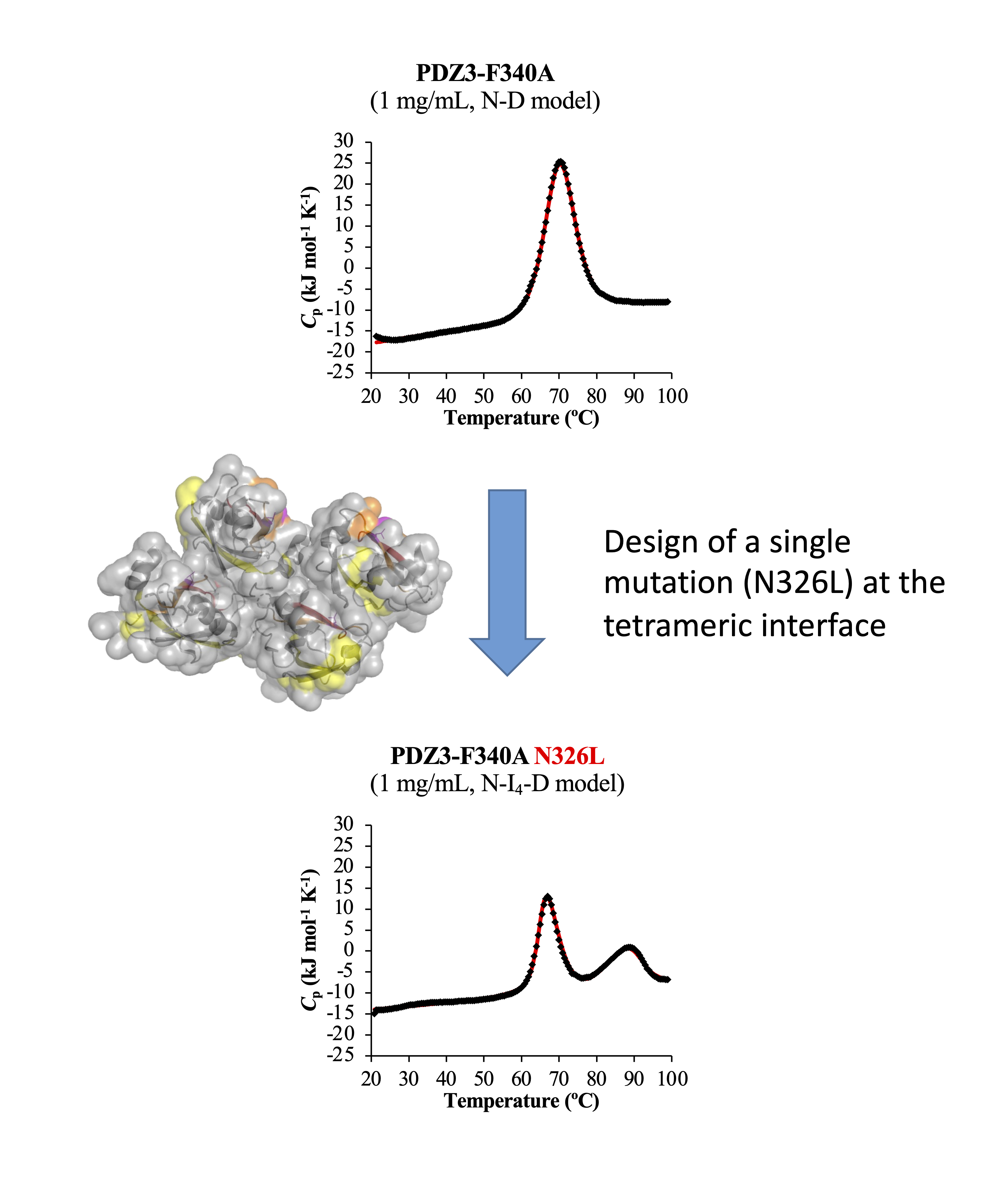
タンパク質のフォールディング・安定性の研究
酵素や抗体などのタンパク質は、天然構造を形成することで機能を発揮するというのが定説です(天然変性領域など例外も見られます)。特に酵素の産業利用や創薬タンパク質において、タンパク質が常温では勿論、高温でも安定に構造を保つことが望ましいです。 しかし、タンパク質の構造を安定化させる設計法はまだ確立しておらず、未だに研究の対象となっています。我々も最近、球状タンパク質の表面に疎水性アミノ酸が露出しいることで、高温で会合体を形成することを解明しました。珍しいことに温度をさらに上げると、会合体はさらに凝集するのではなくモノマーに解離し、タンパク質は変性することが分かりました。このような現象より、球状タンパク質の熱変性で新しい中間状態(熱力学的な)が存在することが示されました。さらに、この状態はタンパク質がアミロイド形成の中間体であること示唆する結果を得ました。アミロイドは多くの神経変性病の原因分子であると考えられており、この基礎研究が新しい治療へ発展することを期待して研究を進めています。
- Onchaiya S., Saotome T., Mizutani K., Martinez JC., Tame JRH., Kidokoro SI., Kuroda Y., Reverse Engineering Analysis of the High-Temperature Reversible Oligomerization and Amyloidogenicity of PSD95-PDZ3. Molecules. 2022 Apr 28;27(9):2813
- Huang YJ., Zhang N., Bersch B., Fidelis K., Inouye M., Ishida Y., Kryshtafovych A., Kobayashi N., Kuroda Y., Liu G., LiWang A., Swapna GVT., Wu N., Yamazaki T., Montelione GT., Assessment of prediction methods for protein structures determined by NMR in CASP14: Impact of AlphaFold2. Proteins. 2021 Dec;89(12):1959-1976
- Saotome T., Onchaiya S., Brindha S., Mezaki T., Unzai S., Noguchi K., Martinez JC., Kidokoro SI., Kuroda Y., Blocking PSD95-PDZ3's amyloidogenesis through point mutations that inhibit high-temperature reversible oligomerization (RO). FEBS J. 2021
- Tomonori Saotome, Maxime Doret, Manjiri Kulkarni, Yin-Shan Yang, Philippe Barthe, Yutaka Kuroda and Christian Roumestand*Folding of the Ig-like domain of the envelope protein from dengue virus analyzed by high hydrostatic pressure NMR at a residue-level resolution Biomolecules. 9,309, 2019 Jul 26;9(8)
- Mohammad, M Islam, Kei Kobayashi, Shun Ichi Kidokoro, Yutaka Kuroda*, Hydrophobic surface residues can stabilize a protein through improved water-protein interactions., FEBS J. 2019 Jun 7
- Islam M M, et al, Crystal structure of an extensively simplified variant of bovine pancreatic trypsin inhibitor in which over one-third of the residues are alanines, Proc. Natl. Acad. Sci. USA, 105:15334-15339 (2008)