
|






|

|




「生体高分子や、両親媒性ブロック共重合体およびその自己組織化体を、『材料の外部や内部』に『機能や界面を与えるツール』として『組み込む』」という独自の高分子材料設計アプローチによって、組織接着性ゲル、薬物徐放性シート、表面機能性粒子などのさまざまな新規なハイブリッド型バイオマテリアル(医療用マテリアル)の開発を進めています。
具体的に説明すると、「ゲル、シート、粒子」という三つの材料形態に着目しながら、以下の研究テーマを展開しています。
1. 治療用マテリアル 〜薬物キャリアとハイブリッド化する〜
2. 診断用マテリアル 〜動的架橋分子でターゲットを認識する〜
3. マイクロマテリアル 〜界面科学を制御する〜
4. ナノマテリアル 〜自己組織化現象を制御する〜
それぞれのテーマの詳細については、以下のまとめをご覧ください。

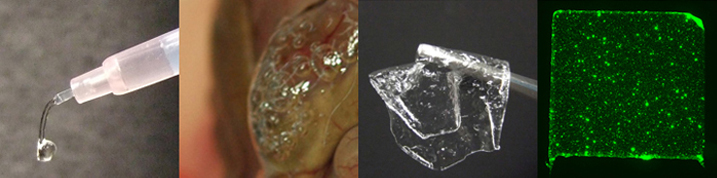
ハイドロゲルは高分子が架橋して形成した三次元網目構造体です。身近な例を示すと、ゼリー、おむつ、こんにゃく、豆腐、寒天などもハイドロゲルです。 ゲルの特性に大きな影響をおよぼす因子は、「高分子主鎖の性質」「高分子主鎖同士のからみ合い」「架橋点の密度」です。しかし、「架橋構造そのものの機能や性質」が「ゲル全体の機能や性質」に及ぼす影響については、ほとんど注目されていないのが現状です。「架橋構造そのもの」に何らかの機能を付与することができれば,新しい医療用ハイドロゲルが創製できると期待されます。
そこで本研究では、「『機能性ユニットが『架橋構造』を形成した』機能性ゲル」という新しいタイプのゲルの開発とその医療応用を展開しています [1-3]。具体的には、ブロック共重合体が形成する「二層構造」高分子ミセルや「三層構造」高分子ミセル等の、「薬物を保持することができる薬物キャリア」に着目して、(1) 表面に反応基を有するミセル状自己組織化体,(2) 側鎖にアミノ基を有する高分子(ポリアミン)、および (3) 生体組織表面に存在するアミノ基、の三成分がシッフ塩基を介して結合する現象を利用した、「薬物キャリアを材料内部に組み込んだ」新しい薬物徐放性バイオマテリアルの開発を目指しています。この機能性ゲルは、ゲルシート状にも加工することができます [4, 5]。この新しいタイプの組織接着性ゲルは、外科手術中に体内の出血部位に滴下して止血する「止血材料」としての応用が可能です [6]。成長因子などのタンパク質を徐放することができれば、再生医療分野への応用も可能です。さらに、「創傷治癒を促すような因子を封入したハイドロゲルを、手術の際に体内術部に留置し、手術後にも継続して治療を行う『術後療法』」や、「液状のハイドロゲル前駆体物質を体内に皮下注入し、体内でゲル化させて得られる『体内留置型の薬物放出デバイス』からの薬物徐放」などの、ドラッグデリバリーシステムを利用した新しい治療法が可能になります。
この材料設計アプローチをさらに展開して、タンパク質を内包した高分子ミセルを内部に分散したシート状の新材料の開発も検討しています(前述のゲルシートではなく、高分子の絡み合いのみで形成するシートです)。乳化処理することによって、両親媒性ブロック共重合体は「親水的な」コアを有するミセルを「有機溶媒中において」形成します。このミセル溶液を基板上にスピンコートすることによって、「内部に親水性物質を内包することが可能なシート状ハイブリッド型材料」が得られます [7-9]。この手法を応用することによって、高分子ミセルが内部に分散した疎水性高分子シートや、高分子微粒子が内部に分散した難溶性高分子(例えばキトサン)シートを作製することができます。
[1] Murakami et al., J. Biomed. Mater. Res. 80A, 421-427 (2007)
[2] Murakami et al., J. Biomed. Mater. Res. B. Appl. Biomater., 91B, 102-108 (2009)
[3] Uchida et al., J. Polym. Sci: B. Polym. Phys., 51, 124-131 (2013)
[4] Ito et al., Mater. Sci. Eng. C, 33, 3697-3703 (2013)
[5] Yoshida et al., J. Biomater. Nanobiotechnol., 6, 36-44 (2015)
[6] Murakami et al., J. Biomed. Mater. Res. B. Appl. Biomater., 91B, 102-108 (2009)
[7] Moroishi et al., Colloids Surf. B: Biointerfaces, 102, 597-603 (2013)
[8] Anzai and Murakami, Colloids Surf. B: Biointerfaces, 127, 292-299 (2015)
[9] Anzai et al., Mater. Sci. Eng. C, 72, 325-331 (2017)


同じ症状を示す患者に同じ薬を投与しても、高い効果が発揮される場合がある一方で、副作用が生じる場合もあります。この「薬への感受性の個人差」は、個人の遺伝子タイプの違いが原因である場合が多いです。このような遺伝子タイプの違いを正確に診断するには、「遺伝子の本体であるDNAを検出する」技術や材料が必要となります。ゲルは、様々な機能性部位や空間部位を組み込むことができる材料であるため、ミクロスケールの現象(物質認識や環境変化)をマクロスケールで情報出力するという用途に適しています。しかし、単純なシグナル(pHや温度等)に応答する環境応答性ゲルは現在までに数多く報告されていますが、分子そのものに応答するゲルの報告は非常に少ないのが現状です。これはなぜでしょうか?
この答えは簡単で、「分子を認識して構造変化するような部位をゲルの中に組み込むのが難しい」ためです。そこで、「分子を認識すると『ダイナミックに』変化する構造」をゲルの中に組み込めば良い、というアプローチに思い至りました。村上は以前、DNAのみを架橋構造として利用したゲルの開発に成功しました [10, 11]。このゲルは、ターゲットとなるDNAの一塩基変異や鎖長さえも厳密に認識して体積変化を示しました(写真)。このような興味深い性質を示すゲルは、現在までにこの例以外には報告されていません。そこで本研究では、さまざまな生体高分子を認識する「診断用のバイオマテリアル」の創製を目指しています。また、新しいRAFT剤(HECPHD)を合成し、診断用バイオマテリアルに組み込むための高分子架橋剤を開発しました [12, 13]。
[10] Murakami and Maeda, Biomacromolecules, 6, 2927-2929 (2005)
[11] Murakami and Maeda, Macromolecules, 38, 1535-1537 (2005)
[12] Kinoshita et al., Polymers, 9, 44 (9 pages) (2017)
[13] Kinoshita et al., J. Polym. Sci. A: Polym. Chem., 55, 1356-1365 (2017)

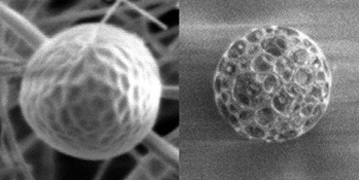
薬物を運ぶ入れ物(薬物キャリア)が血中を安定に循環し、患部において効果を発現するためには、キャリアの粒径や粒子表面の物性制御が重要となります。粒子の表面の改質法として有効な方法は、なんらかの分子による表面修飾です。しかし、高分子ミセルやリポソームなどの表面修飾は比較的容易ですが、反応可能部位に乏しい疎水性高分子から形成した微粒子の表面修飾は非常に困難でそいた。そこで本研究では、「両親媒性ブロック共重合体と疎水性高分子を溶解したo/wエマルション液滴を液中乾燥する」ことによって、あらゆる高分子微粒子の表面に高分子鎖を導入可能な技術を提案しました [14]。現在までに、調製条件を最適化することによって、直径200nm程度の表面修飾粒子の作製に成功しています [15]。
さらに、この技術を応用して、肺から薬物を投与する方法(経肺投与)に適した薬物キャリアの調製も検討しています。その検討過程において、o/wエマルションを「ブロック共重合体共存下で」「噴霧」乾燥した場合のみ、ゴルフボール状の「表面凹型粒子」が得られることを偶然発見しました(写真左) [16]。さらに研究を進めるうちに、o/wマルションを「ブロック共重合体共存下で」「液中」乾燥した場合のみ、「多孔質粒子が得られるはずがない条件(o/wエマルションから『非』多孔質粒子のみが得られる条件)」から「多孔質粒子が得られる」ことも偶然発見しました(写真右) [17]。本研究室が偶然発見したこれらの「表面凹型粒子」と「多孔質粒子」は、肺から薬物を投与するための粒子として極めて適している材料形態です。しかし、これらの特異的な構造体が得られる機構は不明であり、現在、様々な仮説を立ててその形成機構を探っているところです。この研究テーマには、まだ報告されていない未知のエマルションのサイエンスが潜んでいると考えています。
[14] Kanakubo et al., Colloids Surf. B: Biointerfaces, 78, 85-91 (2010)
[15] Yoneki et al., Colloids Surf. A: Physicochem. Eng. Asp., 469, 66-72 (2015)
[16] Takami and Murakami, Colloids Surf. B: Biointerfaces, 87, 433-438 (2011)
[17] Takami and Murakami, Langmuir, 29, 11786-11792 (2013)

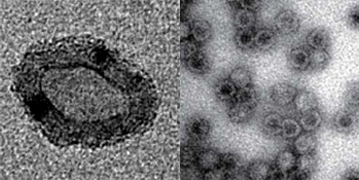
(写真右: Biotechnol. Bioeng., 112, 13-20 (2015))
近年、タンパク質や核酸などの親水性高分子が薬物として利用され始めています。しかし、生体内において分解されやすい生体高分子を薬物として利用するためには、それらを内包して患部まで送達する薬物キャリアが必要となります。そこで本研究では、「タンパク質などの親水性物質を内包可能な自己組織化体」の創製を目指して研究を進めています。
例えば、両親媒性ブロック共重合体からミセルを調製する際に、有機溶媒と水を通常とは逆に用いる(すなわち、有機溶媒が連続相、水が分散相)と、親水性の内核に親水性物質を内包可能な二層構造高分子ミセルが「有機溶媒中」で得られます。この「逆」高分子ミセル表面に,両親媒性ブロック共重合体をさらに配向させることによって、「外殻:親水性,中間層:疎水性,内核:親水性」という「三層構造」を有する高分子ミセルを水中で得ることに成功しました [18, 19]。この新しい自己組織化体は、静電的相互作用を用いずに、どのような組成のブロック共重合体であっても(しかも、内部と外部のブロック共重合体の組み合わせも自由に)得られる調製法に基づいていることが最大の特徴です。
また、タンパク質であるencapsulinが60量体化することによって形成する中空粒子に着目し、親水性タンパク質を内包可能な表面PEG修飾encapsulin中空ナノ粒子の開発へ研究を展開しています [20]。作製したPEG修飾encapsulin中空ナノ粒子を「解離」し、タンパク質を共存させた状態で粒子を「再構成」することによって、薬物を内包したPEG修飾encapsulin中空ナノ粒子を調製することが可能となります。
[18] Uchida and Murakami, Colloids Surf. B: Biointerfaces, 79, 198-204 (2010)
[19] Uchida and Murakami, Colloids Surf. B: Biointerfaces, 84, 346-353 (2011)
[20] Sonotaki et al., Biomater. Sci. (2017) (in press)
|

|