植物酸性ペルオキシダーゼPrxA3aの改変とその基質特異性の解析に関する研究
ペルオキシダーゼとは、一般に過酸化水素存在下に種々の物質(水素供与体)を酸化する酵素です。植物は、様々なペルオキシダーゼをもっており、それぞれがオーキシン生合成や傷害応答反応などの多くの生理的反応に関わっています。そして、そのうちのいくつかはリグニン生合成に関わっていることが知られています。我々が着目しているペルオキシダーゼ、PrxA3aはリグニン生合成の最終段階で働くと考えられています。
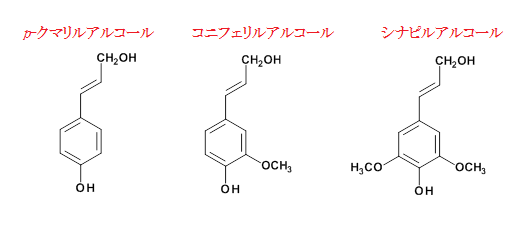
リグニンはフェノール性のポリマーであり、主に3種類のモノマー、シナピルアルコール、コニフェリルアルコール、p-クマリルアルコールから構成されています。リグニン生合成に関わるペルオキシダーゼは過酸化水素の存在下でそれらのリグニンモノマーをラジカル化しランダムに重合させる働きをしています。
当研究室ではポプラ属の交雑ヤマナラシ・キタカミハクヨウ(Populus kitakamiensis)よりprxA3a (DNA data base accession number: D38050)の単離、解析を行いました。prxA3aは酸性ペルオキシダーゼ(peroxidase) PrxA3a (protein_id="BAA07240.1")をコードする遺伝子です。PrxA3aは細胞外分泌シグナルを持ち、リグニン生合成が盛んな組織で遺伝子発現がみられるため、リグニン生合成に深く関与していると推定されています。
コニフェリルアルコールはラジカル局在部位が多いため、ラジカルカップリングによる重合の産物は複雑な網目構造を形成します。一方シナピルアルコールはラジカルが局在する部位が少ないため、その重合の結合様式はβ-β型もしくはβ-O-4型のみとなります。よってシナピルアルコールのみを重合させて生成されるリグニン(Sリグニン)の構造は直鎖上になります。Sリグニンはコニフェリルアルコールを含む重合産物に比べて、単純な構造であり、柔軟になります。リグニンモノマーの組成の違いは、木材の物性の違いにも関係があります。また、製紙過程におけるアルカリ蒸解による脱リグニン操作においても、Sリグニン含量が高いほど脱リグニンされやすくなるといわれています。そのためSリグニン含量を高めた製紙用樹木が求められています。
リグニン生合成に関わるペルオキシダーゼでよく研究が進められているATP-A2 (Arabidopsis thaliana peroxidase A2)
やHPR-C(Horseradish peroxidase C)はコニフェリルアルコールを効率的にラジカル化させますが、シナピルアルコールに対する反応性は低いことが知られています。ATP-A2、HPR-Cとそれぞれ塩基レベルで66.3%、62.2%の相同性をもつPrxA3aも同様の反応性をもち、シナピルアルコールよりコニフェリルアルコールを優先的にラジカル化することが分かっています。これらのペルオキシダーゼがシナピルアルコールに対して反応性が低い理由としてATP-A2におけるヘムの近くのプロリン残基がシナピルアルコールのメトキシ基に対して立体障害になっているという報告があります。HPR-CやPrxA3aにおいてもATP-A2のプロリン残基に当たる構造は存在します。
我々はPrxA3aのアミノ酸の一部を置換することでシナピルアルコールに対して反応性をもつペルオキシダーゼの開発を試みています。野生型PrxA3aに変異を加える際に参考としたのが、白色腐朽菌Phanerochaete chrysosporium由来のリグニン・ペルオキシダーゼ LiPや、ポプラのペルオキシダーゼの一種 CWPO-Cです。LiPは他のペルオキシダーゼとは異なった基質にも反応でき、難分解性環境汚染物質や高分子であるリグニン自体を酸化できることが知られています。この酵素はヘム周辺の立体構造は大型の分子を通過させることができるほどひらいてはいません。しかし幅広い基質特異性を持っています。これはタンパク質表面に近いTrp-171が触媒に関係し、基質酸化部位として働くためです。このTrp-171とヘムとの間で電子のやり取りが起こり、Trp残基の側鎖がラジカル化することで重合基質や高分子であるリグニンを酸化できると考えられています。
CWPO-Cもまた、他の植物ペルオキシダーゼとは異なった基質特異性を持っているペルオキシダーゼです。CWPO-Cはシナピルアルコールに対する酸化能が高いことが知られています。さらに、LiPと同様にリグニンやシトクロムc (13 kDaのヘムタンパク質)などに対しても触媒作用を及ぼします。LiPと同様、CWPO-Cのタンパク質表面に露出したTyr-74及びTyr-177がタンパク質表面基質酸化部位として機能しているためであると推定されています。
PrxA3aにもタンパク質表面基質酸化部位を導入することを狙って変異を加えたところ、変異型酵素のうち、PrxA3a F77Y A165Wが新たにm-クロロフェノールに対し活性を獲得したり、PrxA3a L182Yが2,4,5-トリクロロフェノールに対し反応性を獲得したりするなど、基質特異性が変化したものが確認されました。アミノ酸残基置換による至適pHの変化も確認されました。さらに、ヘムポケットに侵入できないサイズの分子であるシトクロムcに対する酸化能の向上や、シナピルアルコールの高分子化能の獲得から、PrxA3aに置換・導入されたアミノ酸残基であるTrp-165及びTyr-77がタンパク質表面にて基質酸化部位として機能していることを、間接的にではありますが確認しました。
PxA3aに対して、基質特異性に影響を与えると思われるアミノ酸残基を別のアミノ酸残基に置換し、基質特異性試験をある程度変化させることができましたが、目的とした用途に実用可能な程の酸化能をPrxA3aに付与することは残念ながらできませんでした。シナピルアルコールに対する更により高い反応性を有する変異型PrxA3aを生産する植物体を分子育種するためには、PrxA3aの基質特異性に関与する部位の立体構造を正確に知る必要があります。ヘム周辺のアミノ酸配置や酵素の表面基質酸化部位であるTyr残基やTrp残基、またその周辺のアミノ酸残基の立体配置が精確に明らかになれば、それを基により適切な変異を加えることができます。よって現在は野生型及び変異型PrxA3aの正確な立体構造を明らかにするため、X線結晶構造解析を試みることを目指しています。
戻る
