染色体(chromosome)は核を構成する主な要素であり、orcein, haematoxylin,carmineなどの塩基性色素によく染まる。静止核では普通みることはできないが、分裂を開始すると姿をあらわす。有糸分裂(mitosis) は普通、静止期(resting stage),前期(prohase), 中期(metaphase), 後期(anaphase)及び終期(trophase)に分けられるが、染色体の観察に最も都合のよいのが中期である。
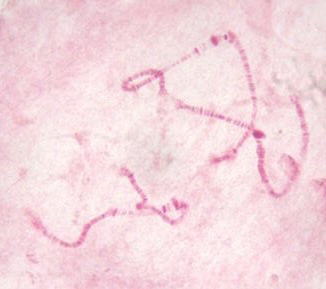 |
染色体と言えば、普通、このような糸状のものを想像します。 左図はユスリカの唾液腺の染色体。 |
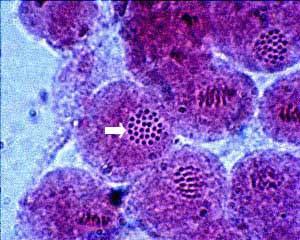 |
しかし、カイコなどの鱗翅目の染色体は●状(白矢印)をしています。 大きさ、長さなどで識別するのは困難です。 何故、丸くなるのかは分かっていません。 左図はカイコの精巣押しつぶし標本 |
水処理押しつぶし法
材料:5令2日目の♂幼虫(この時期の精巣では中期の核が最も多く、観察に適している)。
1)精巣を摘出する。
精巣;腹部第5環節、星状紋の下にあり、星状紋にメスをいれると簡単に飛び出してくる。
慣れないうちは幼虫を腹側から解剖して探す。
2)蒸溜水中に20〜30分間放置する(細胞が水を吸収して膨れる)。
3)これをスライドグラス上に取り出し、精巣被膜を破って内容物をスライドグラス上に出す。
4)酢酸 orceinを1滴落とし、そのまま20分間放置する。
5)カバ−グラスをかけて軽く押しつぶして顕微鏡観察を行う。
* 酢酸orcein ; 45%酢酸 100mlに1gのorceinを溶かす。
 |
低倍率では左図のように細胞質が薄い赤、核や染色体が濃い赤に染まって見えます。 |
| 精巣の押しつぶし標本 | |
カイコ胚子細胞の染色体の観察法
| 試薬 | |||
| リンガ−液 | 0.85% NaCl水溶液 | 9.5ml | コルヒチンは低濃度で大きな効果を示すが、水に溶かしたコルヒチンは余り長持ちしない。1%液は作ってから、冷所に保存して約1ヶ月は持たない。少量をこまめに作った方が確実だと思う。 |
| 1% コルヒチン水溶液 | 0.5ml | ||
| 低張液 | 1% クエン酸ナトリウム | 9.5ml | |
| 1% コルヒチン水溶液 | 0.5ml | ||
| 固定液 | メチルアルコ−ル | 60ml | 固定液は使用直前に作る事。作り置きは不可。 |
| 酢酸 | 20ml | ||
| 染色液 | ギムザ原液 | 2.5ml |
緩衝液とギムザ原液を混ぜた際に、液面に油膜ができるが、染色のむらになるので濾紙などで取り除く。 ギムザ液の濃度はそれ程厳密でなくともよい。2-8%位で染色時間、水洗時間で染色濃度を調節する。 |
| pH6.8 の1/15M ゼ−レンセン・リン酸緩衝液 | 50ml | ||
材料
25℃催青 3-4日目の卵を用いる。胚子は stage17(腹肢突起発現期)から stage21(反転前期)以前の胚子が良い。それ以前の胚子でも観察できるが、胚子が脆いために取り出したり、プレパラ−ト作成にやや手間取る。反転以降の胚子では分裂像が極めて少なくなり、また皮膚が厚くなるため扱いにくい。
方法
プレパラートの作製
1)リンガ−液の中で卵殻を除き、約25℃のコルヒチン入りのリンガ−液の中で約3時間放置する。分裂を盛んに行っている胚子であれば、短時間でも良い。発育の遅い胚子ではやや長めに、6時間位放置しても特に影響はないが、12時間以上放置すると分裂像が極めて多くなり、隣の細胞と区別がしにくくなる、また、正常な分裂像が減り、染色体像の観察には適さなくなる。
2)コルヒチン入りリンガ−液中で漿液膜を破り、胚子を取出す。
3)胚子を低張液に移し、余分の液ごとスライド・ガラスに移す。
4)10〜20分室温に放置する。この間にもコルヒチンの効果があるので放置時間が短いと思われる場合、長めにする。放置時間が長いと思われる場合には短くする。
5)余分な液を除き、やや乾かす。胚子を針でばらばらにする。
6)固定液を入れた染色瓶の上に置き、固定液の気化ガスに約1分さらす。この処理により余分な液を胚子から除く事ができ、残った液も固定液に馴染む。スライド・ガラスを染色瓶に沈める。この際、胚子が乾燥しすぎていると染色体は観察しにくい。また、液が残りすぎていると固定がうまくいかない。
染色瓶中で10分以上固定を行う。スライド・ガラスを染色瓶から取出し、濾紙の上に立て掛け固定液を吸取る。固定液が乾ききる前に水平に置き、固定液Aを1滴、さらに3滴程滴下する。スライド・ガラスの端に溜った固定液を濾紙で吸取り、1晩乾燥させる。
5)以下については次のようにもできる。
余分な液を除き、やや乾かす。胚子を針でばらばらにする。、この際、胚子が乾燥しすぎていると染色体は観察しにくい。また、液が残りすぎていると固定がうまくいかない
6)固定液を1滴、さらに1滴滴下し、固定液がスライド・ガラスに広がるのを待つ。スライド・ガラスの端に余分な液が集まってくる。これを濾紙等で吸い取る。完全に乾く前に固定液をさらに2滴ほど滴下する。この滴下のタイミングは今井(遺伝p101 I.-Q)を参考にするとよい。先程と同様にスライド・ガラスの端に余分な液が集まってくる。これを濾紙等で吸い取る。1晩乾燥させる。
染色
1)染色液を入れた染色瓶にスライド・ガラスを入れ、約1時間染色する。
2)染色後、数秒水洗する。ギムザは水に溶けやすいので注意する。
3)スライドガラスが乾いたら顕微鏡で観察できる。
写真を取りたい場合
1)さらにスライドガラスを完全に乾燥させた後、キシレン中に約10分入れ、脱水する。
2)キシレンから取り出し、カナダバルサムなどの封入剤を1,2滴滴下し、カバーガラスをかけ封入する。
3)数日後、カナダバルサムが固まったら顕微鏡で観察し、写真を撮る。
操作の画像
雑感
■低張液は細胞を膨らませる効果があるというが、あまり顕著な効果は無いようである。
■胚子をばらばらにするのにトリプシンや超音波を用いたが効果は余り無かった。
固定液でいったん固定した後に 60%固定液を滴下し、その後に胚子をばらばらにする方法では、綺麗な分裂像が得られるが、胚子をばらばらにするのが難しく、100発100中というわけにはいかないようである。
■酢酸が強い場合、赤く染色されるようである。乳酸入りの固定液を使うと濃く染まるというが、胚子では余り効果は無いようである。
■pH6.8 の1/15M ゼ−レンセン・リン酸緩衝液のよりもpH10.0位のアルカリ性の緩衝液の方が濃くそまるようだ。
戻る